Gain new perspectives for faster progress directly to your inbox.

Pour parvenir à la décarbonation, nous devons industrialiser le développement des sources d'énergie propres et fiables. L'une des clés de cet abandon des combustibles fossiles sera l'hydrogène, qui peut être stocké pendant une longue durée, puis utilisé à la place du gaz naturel pour alimenter des turbines ou dans des piles à combustible à combustion propre. L'Agence internationale de l'énergie (AIE) précise que pour atteindre la neutralité carbone d'ici à 2050, le monde a besoin d'hydrogène pour satisfaire au moins 10 % de la consommation totale d'énergie.
La production d'hydrogène est déjà en cours, mais 95 % de l'hydrogène produit aux États-Unis est obtenu par l'utilisation de combustibles fossiles pour l'isoler : ce procédé libère d'importantes émissions et ne contribue pas à la décarbonation. C'est la raison pour laquelle la production d'hydrogène propre par craquage des molécules d'eau à l'aide de sources d'énergie renouvelables est importante. L'utilisation de l'énergie solaire pour craquer l'eau et la diviser en ses composants d'hydrogène et d'oxygène a été qualifiée de l'un des « Saint-Graals » de la chimie.
Toutefois, il reste difficile de produire cette réaction sur une échelle suffisamment importante pour la commercialisation. Des propriétés très spécifiques doivent être présentes dans les matériaux concernés, et les scientifiques recherchent depuis des décennies des candidats adéquats. Mes collègues de CAS et moi-même avons récemment exploré l'état de la recherche sur la photocatalyse, et nos résultats issus de CAS Collection de contenusTM démontrent que la communauté scientifique a accompli des progrès considérables vers la viabilité commerciale.
Un travail important reste à faire, mais c'est un moment fascinant pour participer à cette recherche.
Qu'est-ce que la photocatalyse ?
La photocatalyse est une réaction chimique obtenue en irradiant des matériaux semi-conducteurs généralement dispersés dans un milieu aqueux pour former des paires électrons-trous. Démontrée pour la première fois en 1972 par Kenichi Honda et Akira Fujishima, cette réaction se produisait lorsque la lumière frappait une électrode de dioxyde de titane immergée dans l'eau. Les trous créés par cette réaction peuvent attirer d'autres électrons issus des molécules d'eau environnantes, divisant ainsi l'eau en oxygène et en hydrogène.
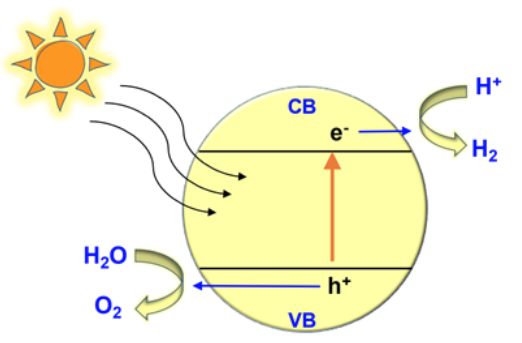
Ce procédé permet de produire de l'hydrogène sans émissions, lequel peut ensuite être stocké pour être utilisé comme combustible propre et en remplacement des combustibles fossiles. La photocatalyse est également prometteuse pour d'autres types de solutions écologiques, en particulier pour la purification de l'eau et la destruction des contaminants des eaux usées. Elle permet de dégrader des micro-organismes et des substances non organiques telles que les teintures et les produits chimiques contenus dans l'eau. Ce procédé pourrait être utilisé pour éliminer les pesticides dans le sol, une avancée majeure de la technologie au-delà des réactions qui se produisent dans l'eau ou dans une solution.
La production d'hydrogène propre sans infrastructure complexe est peut-être l'application la plus urgente de ce procédé. La photocatalyse peut être réalisée en ajoutant une poudre dans l'eau, ce qui est nettement plus simple que l'autre moyen sans émission de produire de l'hydrogène via des électrolyseurs alimentés en énergie solaire. En conséquence, les chercheurs ont accéléré leurs efforts pour identifier les photocatalyseurs adéquats et rendre ce procédé commercialement viable.
Les dernières recherches sur la photocatalyse
En analysant CAS Collection de contenusTM, nous avons constaté que les concepts les plus fréquemment cités dans les revues et les brevets traitaient des réactions photocatalytiques et des propriétés matérielles des photocatalyseurs eux-mêmes. C'est logique, car les photocatalyseurs doivent exploiter la lumière visible pour être économiquement compétitifs par rapport aux combustibles fossiles. La plus grande partie de la lumière solaire se situant dans la plage visible, nous devons l'utiliser comme moyen économique pour produire des réactions à grande échelle. Plus précisément, l'efficacité de la conversion de l'énergie solaire en hydrogène (STH) doit être d'au moins 6 à 10 %.
Quelles propriétés doivent posséder les photocatalyseurs pour atteindre ce résultat ? Tout d'abord, leurs bandes de conduction et de valence doivent se trouver à certaines positions (fig. 2). Le positionnement de ces bandes permet le déplacement des électrons, une propriété des semi-conducteurs qui est nécessaire à la réaction photocatalytique. La bande de conduction doit être négative à zéro volt et la bande de valence doit être positive à 1,23 volt ou plus. Si les bandes d'un photocatalyseur ne se trouvent pas à ces positions, l'énergie sera insuffisante pour produire la réaction.
Ensuite, la bande interdite, c'est-à-dire l'intervalle entre les bandes de conduction et de valence, doit être en mesure d'absorber la lumière visible. Pour satisfaire ce critère, la bande interdite doit se situer entre 1,23 et 3,1 volts. Le dioxyde de titane est un matériau stable dont les bandes se trouvent dans les positions adéquates, mais il n'absorbe pas la lumière visible et ne constitue donc pas une solution économique pour la photocatalyse à grande échelle. Au cours des 10 dernières années, les chercheurs se sont donc tournés vers d'autres photocatalyseurs.
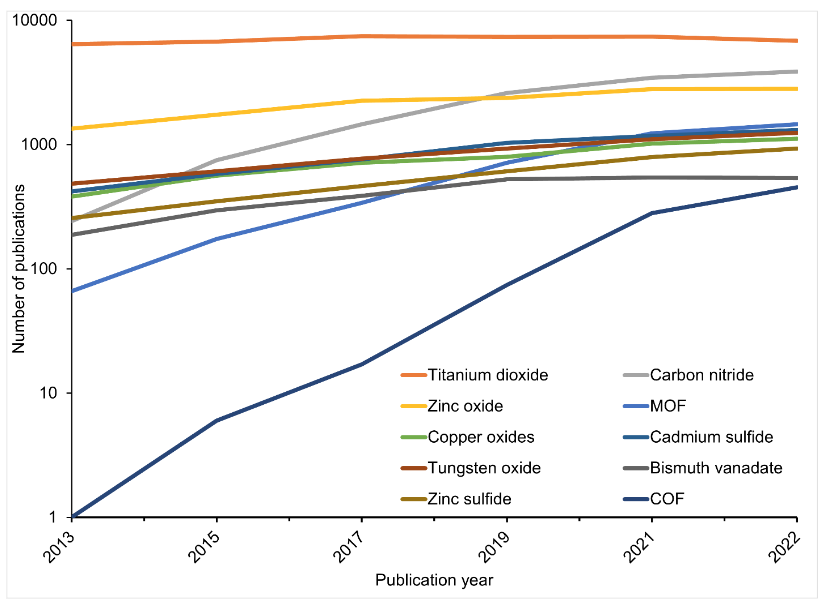
Comme vous pouvez le voir sur la figure 3, les photocatalyseurs les plus étudiés, outre le dioxyde de titane, sont l'oxyde de zinc, le nitrure de carbone, les structures organométalliques (MOF) et plus encore.
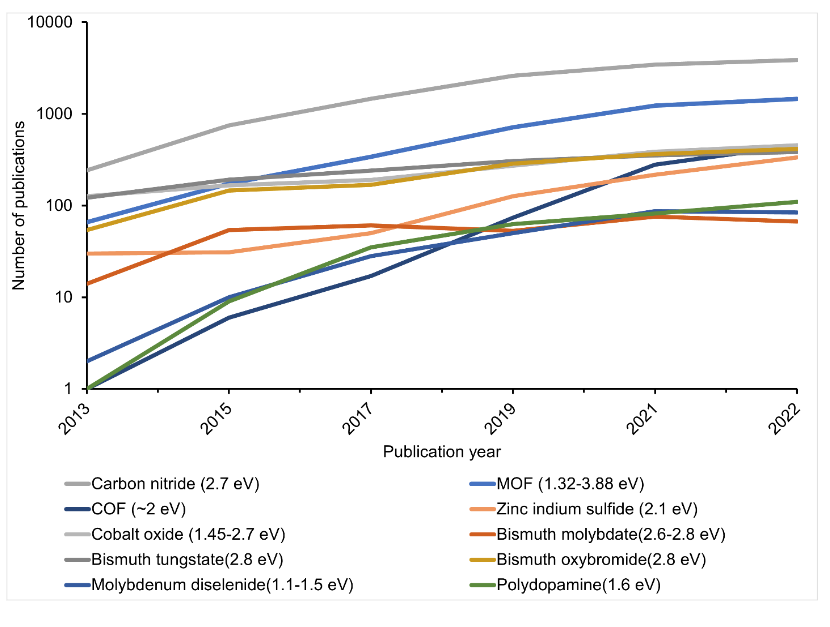
La propriété commune à ces photocatalyseurs est leur bande interdite, qui se situe sous 3 volts et est donc capable d'absorber la lumière visible (fig. 4). Toutefois, malgré ces propriétés, les photocatalyseurs examinés présentent encore certains inconvénients. C'est la raison pour laquelle les scientifiques explorent d'autres options pour améliorer l'efficacité de la réaction.
Les défis futurs
Comme le montre notre analyse, à l'exception de l'utilisation de la lumière solaire concentrée, les photocatalyseurs envisagés n'ont pas atteint le seuil de STH de 6 % (fig. 4).
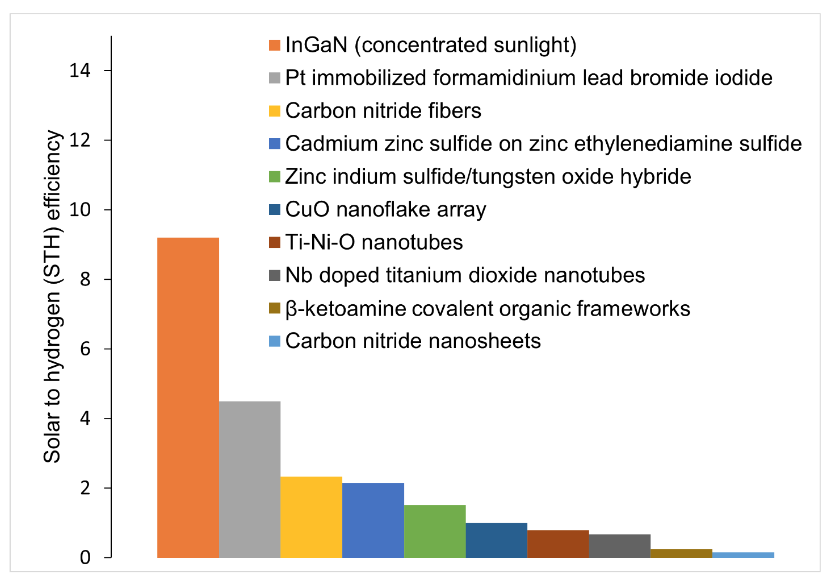
Les chercheurs s'efforcent de combiner les catalyseurs pour obtenir les propriétés adéquates en termes de position des bandes et de bandes interdites. La technique la plus prometteuse à l'étude s'appelle hétérojonction à bande interdite décalée (S-Scheme). Elle consiste à combiner deux photocatalyseurs comportant des structures de bandes décalées. La position de ces bandes lorsqu'elles fonctionnent ensemble peut pousser les électrons à réaliser la réaction photocatalytique de manière robuste et efficace, une étape majeure vers le développement de l'usage de cette technologie.i
Toutefois, cette opération n'est jamais aussi simple que la combinaison de deux catalyseurs. Dès lors que l'on combine les matériaux, d'autres résultats inattendus peuvent se produire. Par exemple, les électrons et les trous peuvent se recombiner avant de réaliser la réaction souhaitée. Les chercheurs étudient des co-catalyseurs qui permettraient de contrôler ce processus de recombinaison. Les co-catalyseurs peuvent être déposés à la surface des photocatalyseurs, ce qui accélère l'utilisation des porteurs de la charge générée. Plusieurs matériaux co-catalyseurs sont à l'étude, ce qui indique que l'avenir de la photocatalyse est dégagé, même s'il reste du travail à faire.
Concrétiser un avenir alimenté à l'hydrogène
Le craquage des molécules d'eau en atomes d'hydrogène et d'oxygène sans produire d'émissions n'est pas une tâche facile : les scientifiques y travaillent depuis des décennies. De gros progrès restent à faire avant que ce procédé ne devienne suffisamment économique pour remplacer les combustibles fossiles par de l'hydrogène propre.
Même si les obstacles sont considérables, il n'y a aucune raison de penser qu'ils sont insurmontables. Une analyse récente de CAS Collection de contenusTM prouve que la recherche innovante sur la photocatalyse est en plein essor. À mesure que les techniques telles que la configuration S-Scheme et l'utilisation de co-catalyseurs se développeront, les avancées de l'efficacité des STH et l'aptitude à commercialiser cette technologie progresseront également.
En poursuivant les expérimentations et les améliorations de la science des matériaux, le monde pourra concrétiser la promesse d'une production d'hydrogène à grande échelle et transformer le rêve d'un avenir décarboné en réalité.