Gain new perspectives for faster progress directly to your inbox.

Para alcançar a descarbonização, precisamos desenvolver fontes de energia limpas e confiáveis em grande escala. Um elemento chave para a transição dos combustíveis fósseis é o hidrogênio, que pode ser armazenado por longos períodos e ser usado como substituto do gás natural para alimentar turbinas ou em células de combustível de queima limpa. A Agência Internacional de Energia (IEA) observa que, para alcançarmos emissões líquidas zero até 2050, o mundo precisa de hidrogênio para suprir pelo menos 10% do consumo total de energia.
A produção de hidrogênio já ocorre atualmente, mas 95% da produção dos EUA é feita a partir da queima de combustíveis fósseis para isolá-lo, um processo com intensas emissões, que não contribui para a descarbonização. Por isso é tão importante a produção de hidrogênio limpo a partir da divisão de moléculas de água com fontes de energia renováveis. O uso de energia para dividir a água em seus componentes, hidrogênio e oxigênio, tem sido chamado de um dos “Santo Graal” da química.
No entanto, ainda é um desafio conseguir essa reação para comercialização em grande escala. É necessária a presença de propriedades muito específicas nos materiais envolvidos, e os cientistas trabalham há décadas para encontrar os candidatos adequados. Recentemente, meus colegas e eu no CAS exploramos a situação atual das pesquisas com fotocatálise e nossas descobertas a partir CAS do Content CollectionTM mostram que a comunidade científica está fazendo progressos significativos na direção da viabilidade comercial.
Ainda há um importante trabalho a ser feito, mas é um momento empolgante para envolver-se nesta pesquisa.
O que é fotocatálise?
A fotocatálise é uma reação química realizada pela irradiação de materiais semicondutores, geralmente dispersos em meio aquoso, que forma pares de elétrons e buracos. Demonstrada pela primeira vez em 1972 por Kenichi Honda e Akira Fujishima, a reação ocorreu quando a luz incidiu sobre um eletrodo de dióxido de titânio submerso em água. Os buracos criados pela reação permitem extrair mais elétrons das moléculas de água circundantes, dividindo assim a água em oxigênio e hidrogênio.
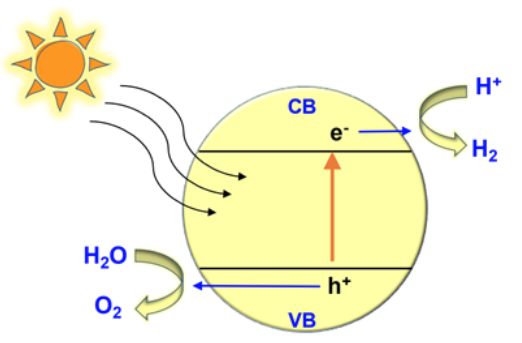
Esse processo resulta na produção de hidrogênio sem emissões, que pode então ser armazenado para ser utilizado como combustível de queima limpa e como substituto de combustível fóssil. A fotocatálise também é promissora para outros tipos de remediação ambiental, em particular para a purificação da água e destruição de contaminantes de águas residuais. Micro-organismos e substâncias não orgânicas, como corantes e produtos químicos na água foram degradados com sucesso pela fotocatálise. O processo pode ser viável para a remediação de pesticidas no solo, um avanço importante na tecnologia que vai além das reações que ocorrem na água ou em uma solução.
A produção de hidrogênio limpo sem infraestruturas complexas é sem dúvida a aplicação mais urgente deste processo. A fotocatálise também pode ser realizada pela adição de um pó à água, muito mais simples que a outra forma, que produz hidrogênio livre de emissões via eletrolisadores movidos a energia solar. Como resultado, os pesquisadores aceleraram os esforços para encontrar os fotocatalisadores certos e tornar o processo comercialmente viável.
As pesquisas mais recentes em fotocatálise
Ao analisar o CAS Content CollectionTM, descobrimos que os conceitos mais comuns citados na literatura de periódicos e patentes abordavam reações fotocatalíticas e as propriedades dos materiais dos próprios fotocatalisadores. Isto faz sentido porque os fotocatalisadores devem usar luz visível para poderem competir economicamente com os combustíveis fósseis. A maior parte da luz solar incide na faixa visível, por isso precisamos usá-la como uma forma acessível de gerar reações em grande escala. De forma específica, a eficiência da energia solar em hidrogênio (STH) deve ser de pelo menos de 6 a 10% ou superior.
Quais são as propriedades necessárias dos fotocatalisadores para conseguir esse feito? Primeiro, as bandas de condução e valência devem estar em determinadas posições (Fig. 2). A colocação dessas bandas permite o movimento de elétrons - uma propriedade dos semicondutores e uma parte necessária da reação fotocatalítica. A banda de condução deve ser negativa em zero volts e a banda de valência deve ser positiva em 1,23 volts ou mais. Se as bandas do fotocatalisador não estiverem nestas posições, não haverá energia suficiente para a reação.
Em segundo lugar, o intervalo de bandas, isto é, o espaço entre as bandas de condução e de valência, deve ser capaz de absorver a luz visível. Para atender a esse critério, o intervalo de banda deve estar entre 1,23 e 3,1 volts. O dióxido de titânio é um material estável com bandas em posições adequadas, mas não consegue absorver luz visível, por isso não será econômico para fotocatálise em grande escala. Os pesquisadores dos últimos 10 anos recorreram a outros fotocatalisadores.
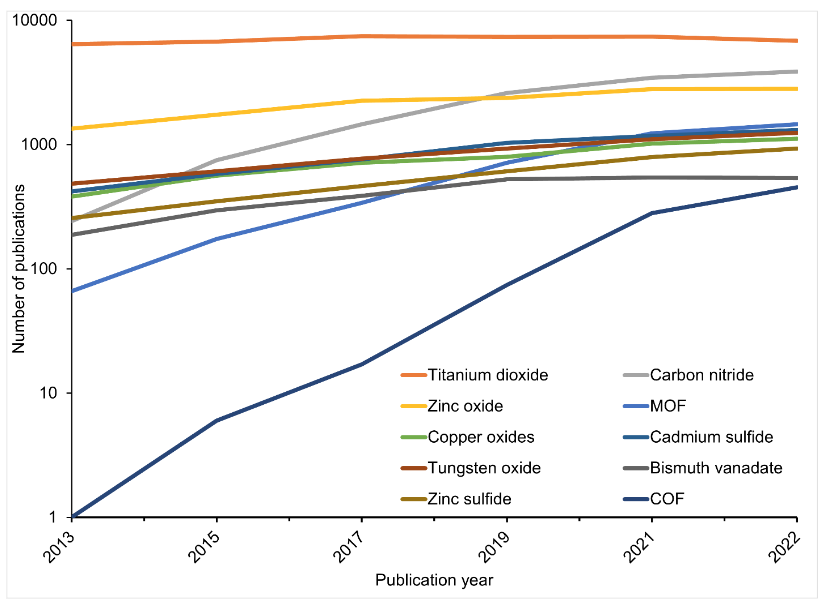
Como é possível ver na Figura 3, dentre os fotocatalisadores mais estudados, além do dióxido de titânio, estão o óxido de zinco, nitreto de carbono, estruturas metalorgânicas (MOF) e muitas outras:
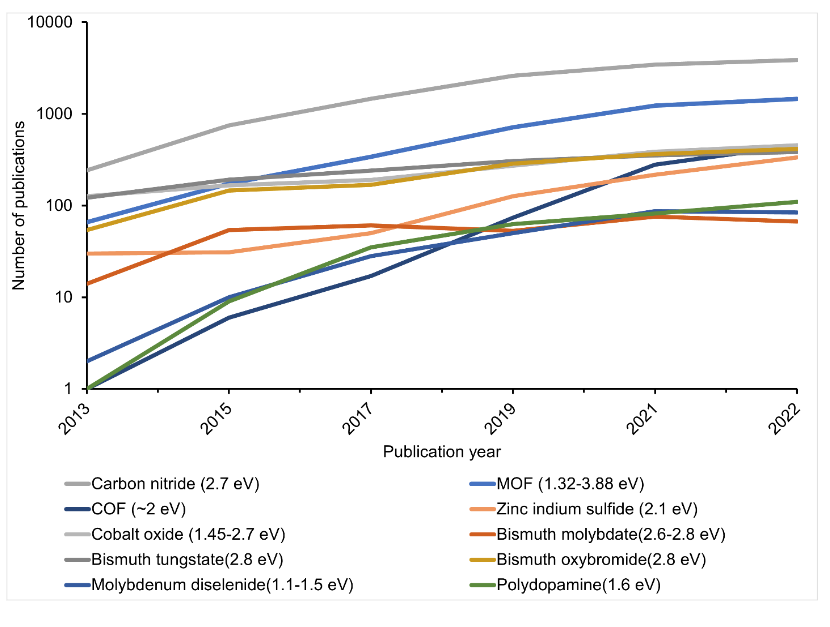
A propriedade comum entre esses fotocatalisadores é o seu intervalo de banda, que está abaixo de 3 volts e, portanto, conseguem absorver a luz visível (Fig. 4). Apesar de terem essas propriedades, no entanto, os fotocatalisadores examinados ainda apresentam deficiências. Como resultado, os cientistas estão explorando mais opções para melhorar a eficiência da reação.
Desafios à frente
Como mostra nossa análise, com exceção do uso de luz solar concentrada, os fotocatalisadores em estudo não atingiram o limite de STH de 6% (Fig. 4).
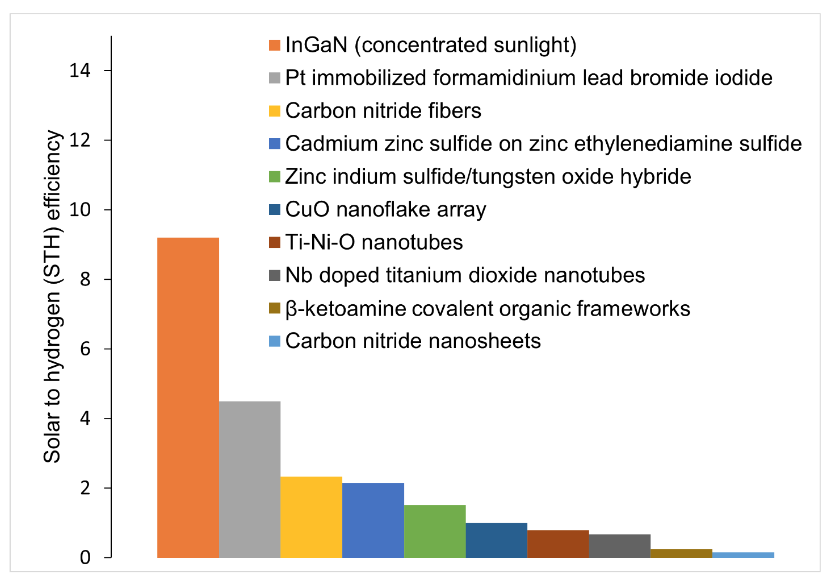
Os pesquisadores estão tentando combinar catalisadores para obter as propriedades corretas das posições e intervalos de banda. A técnica mais promissora em estudo é chamada de heterojunção de esquema escalonado (esquema S) ou combinação de dois fotocatalisadores com uma estrutura de bandas escalonadas. A posição das bandas, quando trabalham juntas, pode levar os elétrons a realizar a reação fotocatalítica de forma robusta e eficiente, um passo importante para expandir o uso desta tecnologia.i
No entanto, nunca é muito simples combinar dois catalisadores. Quando materiais são combinados, podem ocorrer resultados inesperados. Por exemplo, os elétrons e buracos podem recombinar antes de realizarem a reação desejada. Os pesquisadores estão explorando cocatalisadores para controlar o processo de recombinação. Os cocatalisadores podem ser depositados sobre a superfície dos fotocatalisadores para acelerar a utilização dos portadores de carga gerados. Estão sendo pesquisados diversos materiais cocatalisadores, o que mostra que o futuro dos fotocatalisadores é brilhante, mesmo que ainda exista muito trabalho a ser feito.
Transformando o futuro movido a hidrogênio em realidade
Dividir as moléculas de água em hidrogênio e oxigênio sem produzir emissões não é uma tarefa simples, os cientistas vêm trabalhando nisso há décadas. Ainda são necessários progressos consideráveis antes que este processo seja suficientemente eficaz em termos de custos para substituir os combustíveis fósseis por hidrogênio limpo.
Embora os desafios sejam tremendos, não há razão para acreditar que sejam intransponíveis. Uma análise recente do CAS Content CollectionTM prova que há um crescimento da pesquisa inovadora sobre fotocatalisadores. À medida que aumentam técnicas como a configuração do esquema S e o uso de cocatalisadores, também aumentam os avanços na eficiência do STH e a capacidade de comercializar esta tecnologia.
Com experimentação contínua e melhorias na ciência dos materiais, o mundo pode cumprir a promessa da produção de hidrogênio em grande escala e transformar o futuro descarbonizado em realidade.