« Nous sommes au cœur d'une révolution thérapeutique », selon les auteurs d'un article de synthèse publié récemment dans Frontiers in Bioengineering and Biotechnology. Ils commentaient l'expansion rapide des traitements par ARN dans la recherche moderne et le développement clinique, suscitée en partie par l'intérêt pour les vaccins à ARN contre la COVID-19 dans le cadre de la pandémie actuelle de SARS-CoV-2.
Traditionnellement, le développement de médicaments est dominé par les substances dites à petites molécules (définies comme tout composé organique de poids moléculaire faible), qui ont toujours de nombreuses applications en médecine. Toutefois, les progrès de la biotechnologie et de la biologie moléculaire ont depuis permis aux chercheurs de concevoir des agents macromoléculaires qui vont des anticorps monoclonaux et des protéines recombinantes aux oligonucléotides et aux gènes/fragments de gènes comme candidats médicaments. En conséquence, les « éléments biologiques » sont devenus des intervenants clés dans la trousse à outils thérapeutiques disponible aujourd'hui. Début 2020, les éléments biologiques comprenaient sept des 10 médicaments les plus vendus dans le monde.
En outre, la conception de médicaments à base d'acide nucléique est apparue et connaît aujourd'hui une expansion rapide. Même si le développement clinique de traitements à base d'ARN a traditionnellement été entravé par des difficultés telles que l'efficacité et l'immunogénicité, le succès récent des vaccins à ARN messager contre la COVID-19 et l'approbation de plusieurs médicaments à base d'ARN ont donné un élan considérable à ces thérapies. À l'aide de la collection de contenus CAS™ – la plus grande collection de connaissances scientifiques publiées et organisées par l'Homme -, nous examinons les usages de l'ARN dans la médecine moderne.
Lire le rapport CAS Insights associé : « Médicaments dérivés de l'ARN : examen des tendances de la recherche et des développements »
Avantages et difficultés des traitements à base d'ARN
Cibler le « non-médicamentable »
L'un des avantages majeurs des thérapies par ARN tient au fait que les médicaments à base d'ARN peuvent être utilisés pour cibler les molécules « non médicamentables », qui sont difficiles, voire impossibles à cibler avec des médicaments à base de petites molécules. Seulement un cinquième environ des protéines peut être ciblé par des médicaments d'usage courant, y compris les petites molécules et les anticorps, et il n'est pas possible de cibler des ARN non codants en utilisant des petites molécules ou des anticorps monoclonaux (lesquels se lient à des poches de récepteurs de protéines ou d'enzymes du site actif, ce qui nécessite une traduction antérieure).
Facilité de synthèse
Les produits de l'ARN peuvent présenter des avantages majeurs en termes de fabrication par rapport aux protéines en ce qui concerne la simplicité, l'économie et la rapidité des processus de fabrication qui sont particulièrement pertinents dans le développement récent des vaccins à ARN. Les stratégies à base d'acide nucléique peuvent aussi contourner l'exigence de procédés de synthèse complexes comme les modifications post-traduction en utilisant la machinerie cellulaire de la cellule de mammifère.
En outre, la séquence de l'ARN peut être ajustée rapidement et, ainsi, fournir des molécules sur mesure pour différentes cibles. Cela accélère considérablement le processus de développement, comme on a pu clairement le constater avec le développement rapide des vaccins à ARN contre la COVID-19.
Sécurité et effets secondaires
Comme ils pénètrent dans le noyau, les médicaments à ARN sont source de préoccupations en termes de sécurité liées à leur intégration potentielle au génome de l'hôte. Outre les ARN utilisant le système CRISPR-Cas qui modifient le génome, les ARN n'altèrent pas le matériau génomique et ne présentent aucun risque d'intégration génomique.
Toutefois, les traitements par ARN peuvent présenter des problèmes de spécificité qui risquent de produire des effets secondaires, et leur susceptibilité à la dégradation peut aboutir à une pharmacodynamique médiocre qui complique leur utilisation. Certains de ces problèmes peuvent être atténués en modifiant chimiquement l'ARN, un sujet sur lequel les recherches se sont concentrées.
Administration
Les traitements par ARN présentent habituellement des molécules de grande taille comparées aux traitements à petites molécules, et leur charge électrique est élevée, ce qui complique l'administration intracellulaire sous leur forme native.
Tendances de la recherche sur les traitements par ARN
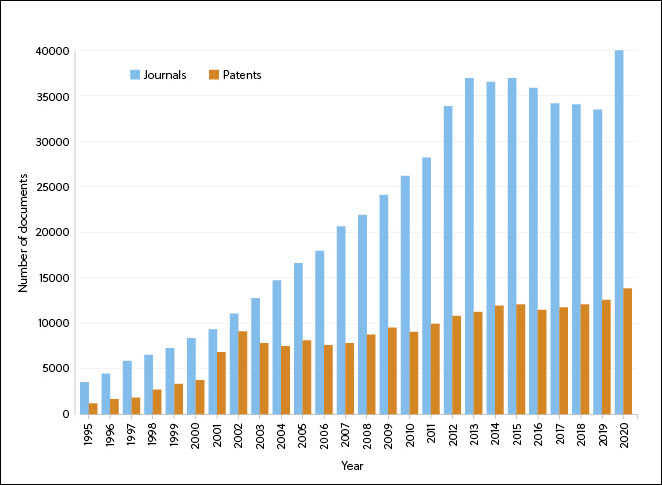
Depuis 1995, le nombre de revues et de brevets contenant des informations sur les traitements par ARN n'a cessé d'augmenter, avec un pic du nombre de brevets vers 2001 (peut-être lié au premier essai clinique sur l'être humain utilisant des cellules dendritiques transfectées par des antigènes tumoraux codant l'ARN messager) et un nombre maximum de revues en 2020 (très probablement lié à l'intérêt pour les vaccins à ARN messager contre la COVID-19) (Figure 1).
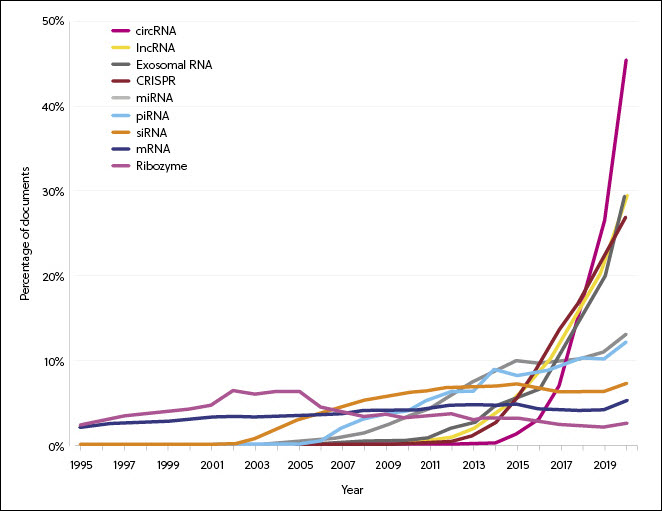
La recherche sur l'ARN s'est progressivement diversifiée à mesure que de nouveaux types d'ARN ont été découverts, en particulier dans les domaines du siRNA, miRNA, lncRNA et CRISPR (Figure 2). Les taux d'augmentation des volumes de publication de circRNA, d'ARN d'exosome, d'lncRNA et de CRISPR est nettement plus rapide que le reste. Il est à noter que la technologie CRISPR représente 20 % de l'ensemble des demandes de brevet liés à l'ARN en 2020. Cela coïncide avec un nombre croissant d'approbations de thérapies à base de CRISPR pour la participation à des essais cliniques.
La perturbation de la fonctionnalité des ARN récemment découverts est considérée comme un outil de traitement prometteur pour surmonter les faiblesses des approches thérapeutiques traditionnelles (Tableau 1).
| Type d'ARN | Fonctions thérapeutiques |
| ARN messager | Le principe de base des traitements à ARN messager implique l'administration d'ARNm transcrit in vitro dans une cellule cible, où l'ARNm est traduit en une protéine fonctionnelle, c'est-à-dire en anticorps, antigènes et cytokines. |
| siRNA | Par le biais d'une dégradation ciblée de l'ARNm, le siRNA induit un silençage génique spécifique à la séquence dans la pathogenèse de différentes maladies associées à un patrimoine génétique connu. |
| miRNA | Le miRNA peut compromettre l'expression de plusieurs gènes cibles différents, simultanément en induisant une dégradation ciblée de l'ARNm ou une répression de la traduction de l'ARNm. |
| IncRNA | Les lncRNA sont un grand groupe de gènes d'ARN structurellement complexes qui peuvent interagir avec l'ADN, l'ARN ou les molécules de protéines (histones) pour réguler la transcription des gènes via des modifications épigénétiques (principalement via la méthylation et l'acétylation). |
| circRNA | Les circRNA peuvent séquestrer ou translocaliser les protéines entre les compartiments subcellulaires. La dysrégulation des circRNA a été impliquée dans un certain nombre de maladies, en particulier des cancers, et des maladies cardiovasculaires et neurologiques. De manière spécifique à certains tissus ou à certaines cellules, les approches à base de gain ou de perte de fonction sont généralement réalisées à l'aide de l'expression des circRNA. |
| piRNA | Les piRNA peuvent se lier à des protéines piwi pour former un complexe piRNA/piwi, influençant ainsi le silençage des transposons, la spermiogenèse, la réorganisation du génome, la régulation épigénétique, la régulation des protéines et la gestion des cellules souches germinales. |
| Ribozyme | Les enzymes d'ARN, aussi appelées ribozymes, sont des molécules d'ARN catalytiques qui reconnaissent leur ARN cible de manière hautement spécifique à la séquence afin de réguler à la baisse et de réparer les gènes pathogéniques. Elles peuvent par conséquent être utilisées pour traiter un certain nombre de maladies qui vont des troubles métaboliques congénitaux aux infections virales et aux maladies acquises comme le cancer. |
| ARN d'exosome | Les exosomes sont des types de nanovésicules extracellulaires potentiellement utilisées pour le diagnostic ou le traitement de différentes indications pathologiques. Les recherches en cours étudient le potentiel de détection de l'ARN d'exosome dans le diagnostic clinique. À des fins thérapeutiques, l'administration de petits ARN basés sur les exosomes est utilisé comme un outil de silençage génique post-transcription par dégradation catalytique ou par arrêt de la traduction de l'ARN ciblé. |
| CRISPR | Le système CRISPR-Cas9 est l'une des technologies d'édition génomique à séquence spécifique les plus polyvalentes et les plus efficaces que l'on puisse utiliser pour l'édition génomique, l'enquête sur la fonction génétique et la thérapie génique. À ce jour, le CRISPR-Cas9 a été largement utilisé dans les maladies génétiques, y compris la myopathie de Duchenne, le déficit en alpha-1-antitrypsine, l'hémophilie, la perte d'audition et les maladies hématopoïétiques. |
Quels domaines de traitement sont ciblés par les traitements par ARN ?
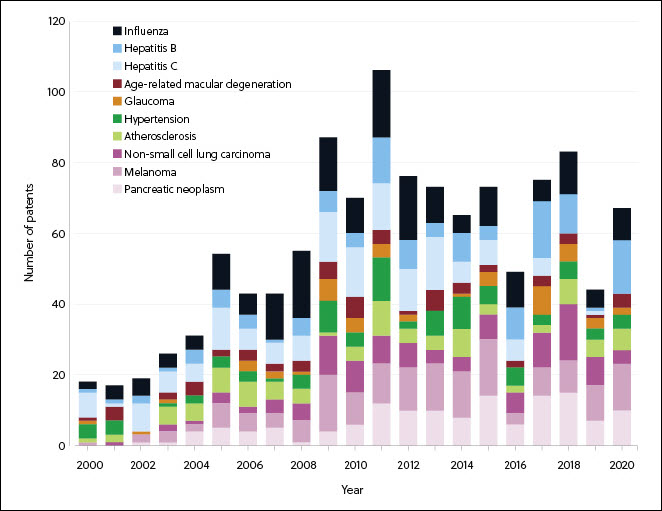
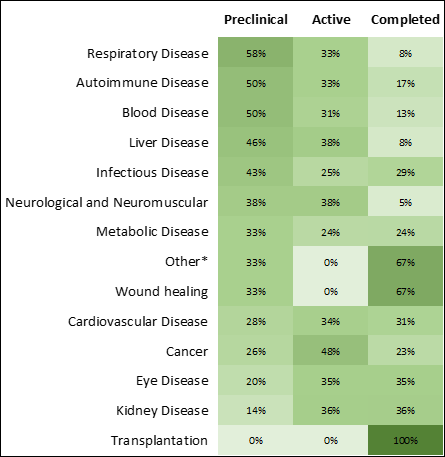
Les maladies infectieuses et le cancer présentent la croissance la plus importante et le plus grand nombre de thérapies dans les phases de recherche (Figures 3 et 4). La pandémie de COVID-19 a entraîné une forte hausse des médicaments à ARN pour les maladies infectieuses à la fois dans les phases de recherche et dans le nombre de traitements approuvés (Figure 4), ce qui a amené sur le marché les premiers traitements à ARN messager approuvés.
Relever les défis des traitements par ARN
La modification chimique de l'ARN peut être utilisée pour protéger l'ARN de la dégradation et améliorer la spécificité de la cible, réduisant ainsi le risque d'effets secondaires dus à des effets hors cible. Outre la modification chimique, on peut utiliser des moyens d'administration comprenant des nanomatériaux pour protéger l'ARN de la dégradation et favoriser le transport du traitement jusqu'à la cible souhaitée.
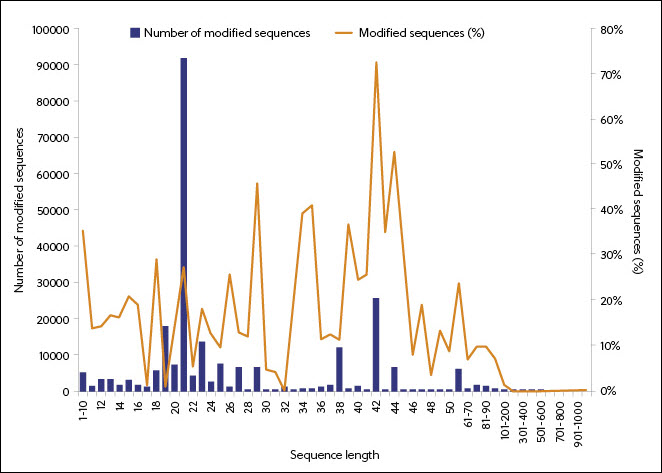
Selon les données de la collection de contenus CAS, l'utilisation de la modification de l'ARN a commencé à prendre son essor en 1995 et est associée à des longueurs de séquence plus courtes (Figure 5). La prédominance des ARN comprenant 18 à 27 nucléotides modifiés reflète l'utilisation de cette longueur de séquence dans des formes particulières d'ARN (siRNA et ASO). L'examen des modifications dans les médicaments à ARN approuvés par la FDA confirme la corrélation entre le type d'ARN et ses modifications.
Modifications de la base d'ARN
Les nucléotides non canoniques avec des modifications qui perturbent la formation de liens d'hydrogène peut déstabiliser thermiquement la formation d'un duplex avec la cible et améliorer ainsi la spécificité de la cible en limitant la liaison hors cible. En outre, la modification peut améliorer la performance de l'ARN thérapeutique. L'utilisation de la N1-méthylpseudouridine à base modifiée dans les ARN messagers thérapeutiques, comme dans les vaccins contre la COVID-19, améliore la traduction et réduit les effets secondaires cytotoxiques et la réponse immunitaire à l'ARN messager. Les vaccins à ARN messager Comirnaty de Pfizer et Spikevax de Moderna utilisent également des coiffes de 7-méthylguanosine liées par un 5’ triphosphate jusqu'à l'extrémité 5' de l'ARN messager, dupliquant les coiffes d'ARN messager présentes dans la nature qui empêchent la dégradation de l'extrémité 5' de l'ARN messager.
Modifications sur le ribose
Les modifications à la position 2' du ribose dans l'ARN peuvent augmenter la stabilité et réduire les effets hors cible. Les modifications les plus courantes à la position 2' comprennent la 2’-O-méthylation, la 2’-fluoro, le 2’-O-méthoxyéthyl (MOE) et le 2’-amine.
Modification du squelette
Les modifications au niveau du groupe des phosphates dans le squelette glucidique peuvent améliorer l'administration d'ARN en neutralisant la charge négative qui peut perturber le transport à travers les membranes et en conférant une résistance accrue aux nucléases, prolongeant ainsi la demi-vie d'élimination de leurs tissus. L'une des modifications du squelette les plus largement utilisées est le phosphorothioate.
Recherches liées aux nanotransporteurs d'ARN
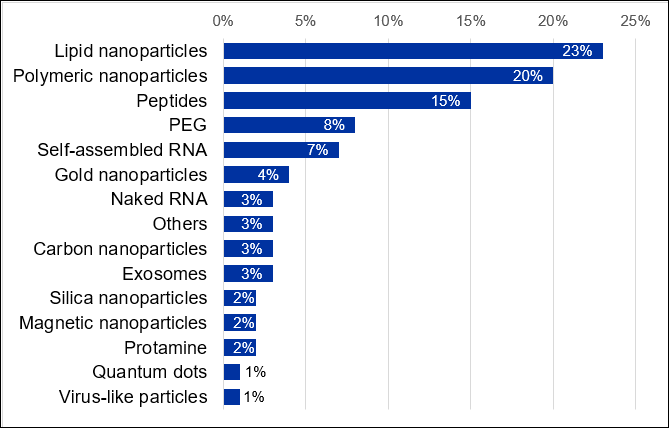
Même si les obstacles biologiques comme l'immunogénicité et la stabilité des nucléases sont généralement surmontés en modifiant la structure chimique de l'ARN, des systèmes d'administration supplémentaires sont nécessaires pour surmonter d'autres barrières dans le corps. L'encapsulation de l'ARN dans des nanoparticules est un moyen efficace de protéger et d'administrer l'ARN. Il existe actuellement près de 7 000 publications scientifiques dans la collection de contenus CAS liées aux systèmes d'administration de l'ARN. Les études liées aux transporteurs d'ARN sont dominées par les nanoparticules lipidiques, suivies de près par les nanotransporteurs polymériques (Figure 6).
Conclusions
Les traitements par ARN représentent une catégorie de médicaments en expansion rapide qui devraient modifier la norme des soins pour de nombreuses maladies. Ils présentent plusieurs avantages par rapport aux médicaments traditionnels basés sur des petites molécules et molécules biologiques, car ils sont économiques, relativement simples à fabriquer et capables de cibler des sites précédemment « non médicamentables ». Les difficultés classiques rencontrées avec leur stabilité, leur administration et leurs effets hors-site peuvent être éliminées ou réduites via des modifications chimiques et des nanotransporteurs d'ARN. Une recherche dans la collection de contenus CAS a mis en évidence des maladies infectieuses comme la COVID-19 et le cancer en tant que domaines thérapeutiques clés pour les ARN et démontré que les taux d'augmentation des volumes de publications concernant le circRNA, l'ARN d'exosome, l'lncRNA et le CRISPR sont particulièrement élevés, avec une explosion actuelle notable dans la recherche liée au CRISPR.
Écoutez les experts
Pour obtenir des informations supplémentaires, consultez le webinaire récent sur l'ACS afin de savoir ce qui intéresse le plus les responsables actuels de la mise au point de traitements par ARN. Ce débat fait intervenir des experts de différents domaines de recherche, notamment :
- Le Dr John P. Cooke, directeur médical du Centre des traitements par ARN
- Le Dr Robert DeLong, professeur adjoint au Centre d'innovation des nanotechnologies à l'université d'État du Kansas
- Le Dr Barb Ambrose, documentaliste scientifique en chef chez CAS
- Le Dr Ramana Doppalapudi, vice-présidente de la chimie chez Avidity Biosciences
- Animé par le Dr Gilles Georges, vice-président et directeur scientifique chez CAS