Gain new perspectives for faster progress directly to your inbox.

En tant que classe thérapeutique, les inhibiteurs covalents ont gagné en popularité ces dernières années, l'U.S. Food and Drug Administration (FDA) ayant approuvé un certain nombre de médicaments covalents dans plusieurs indications, ciblant principalement les traitements contre le cancer. Leur mécanisme d'action unique offre plusieurs avantages par rapport aux inhibiteurs non covalents plus courants, de sorte qu'ils représentent une voie prometteuse pour le développement thérapeutique.
Historiquement, les chercheurs se méfiaient des recherches sur les inhibiteurs covalents en raison des problèmes de sécurité et des difficultés liées à leur conception et à leur fabrication. Cependant, la tendance est en train de s'inverser.
Depuis 2000, CAS a identifié plus de 10 000 articles scientifiques évoquant un sous-ensemble d'inhibiteurs covalents. Les efforts de recherche se sont notamment intensifiés au cours des dix dernières années, les publications dans les revues ayant quadruplé depuis 2010 (figure 1).
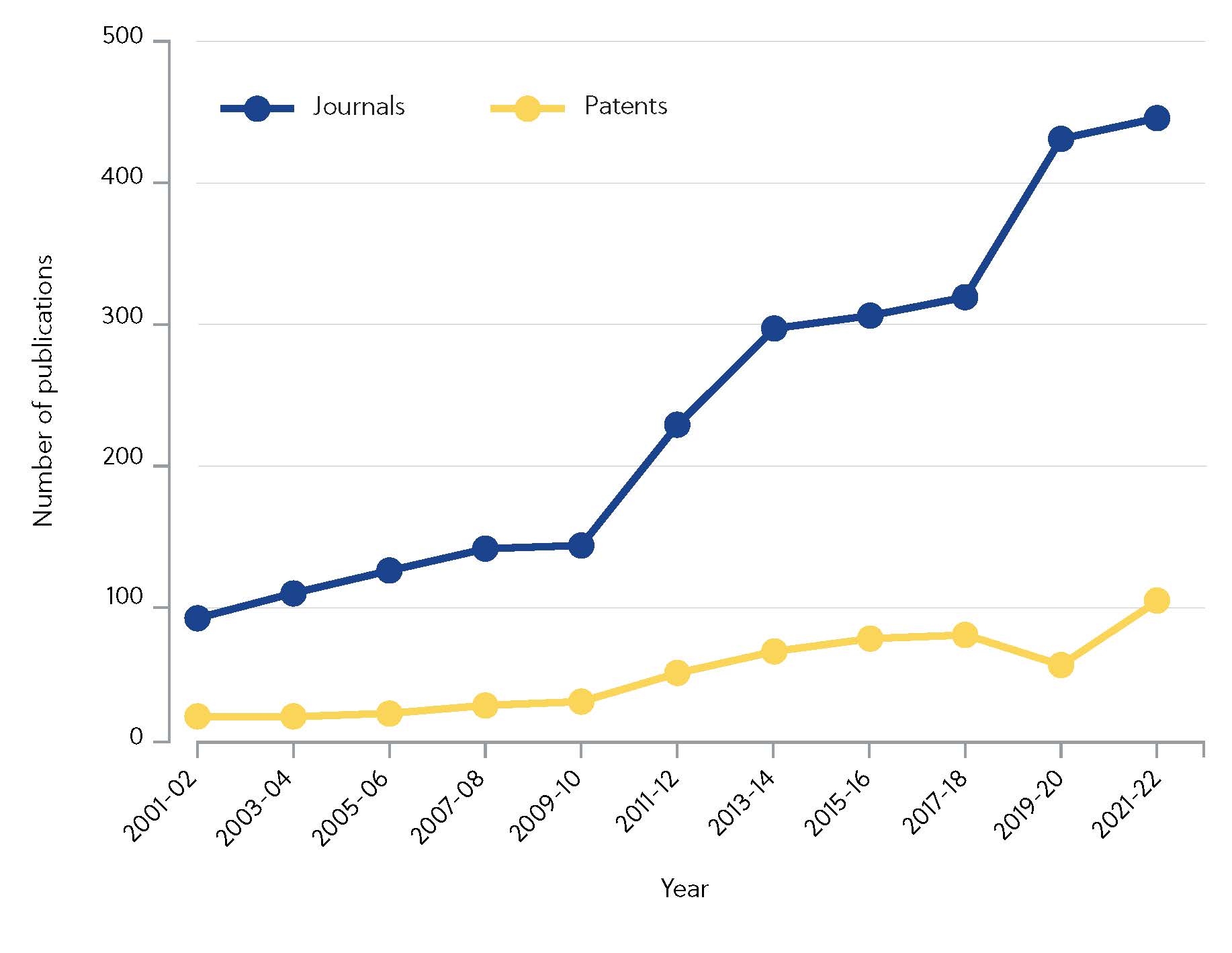
L'investissement est rentable, avec les médicaments covalents phares ibrutinib et osimertinib générant des ventes représentant un total de 4,33 milliards de dollars en 2020. La question demeure : que sont exactement les inhibiteurs covalents et pourquoi les entreprises et les laboratoires de recherche commencent-ils à les privilégier par rapport aux inhibiteurs non covalents ?
Comme l'indique leur nom, les inhibiteurs covalents forment un lien covalent avec leurs protéines ciblées, qu'ils modifient souvent de manière irréversible. Contrairement aux inhibiteurs non covalents, dont la liaison est réversible, les inhibiteurs covalents créent une connexion durable avec leur cible, qui renforce leur puissance et prolonge leur durée d'action. Cela peut présenter des avantages et des inconvénients.
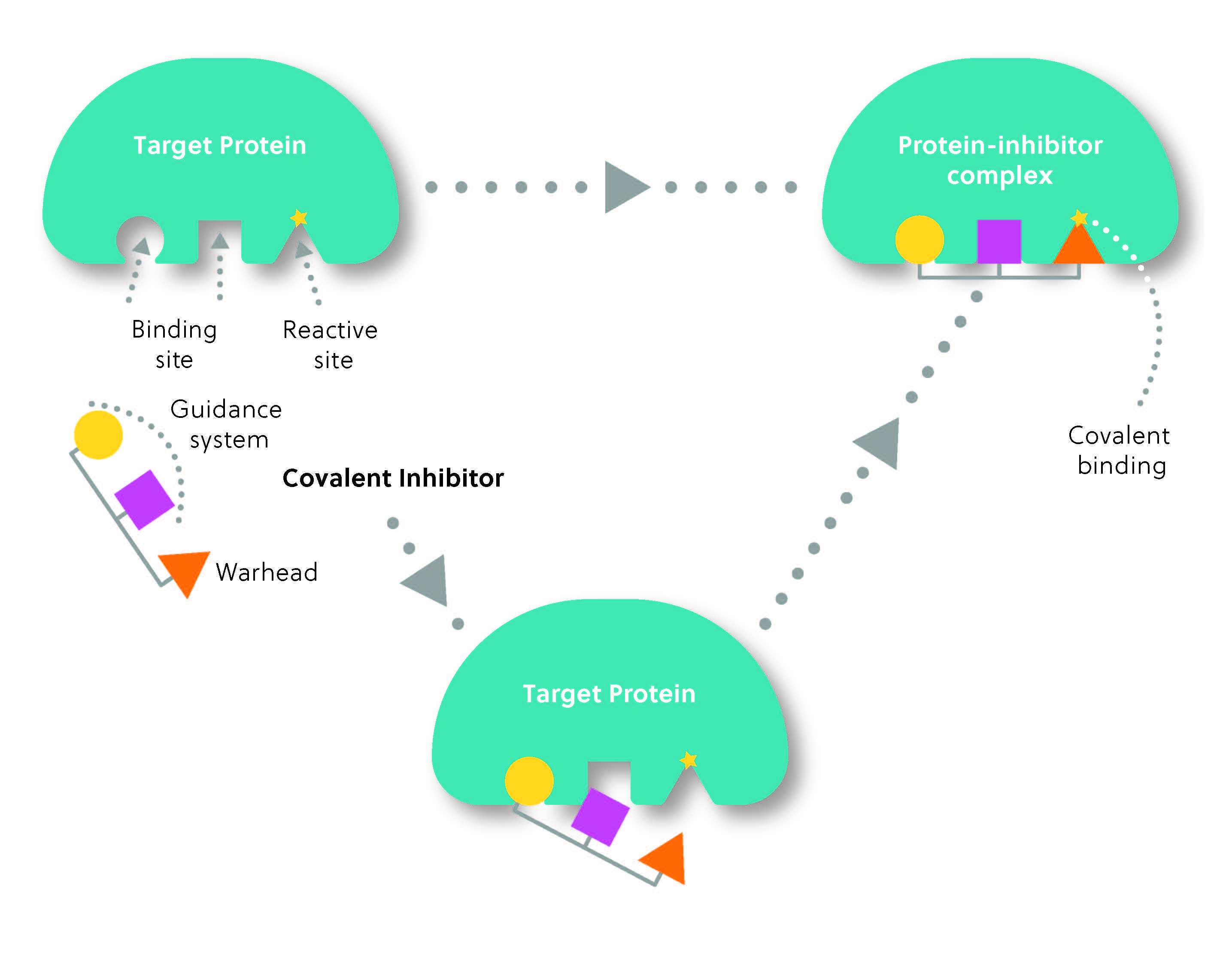
La structure d'un inhibiteur covalent comprend généralement deux parties : le groupe réactif, ou « charge explosive », qui forme le lien covalent avec la cible et le « système de guidage », qui détermine la sélectivité de l'inhibiteur pour sa cible (figure 2). On peut considérer cela comme un missile à tête chercheuse : le système de guidage localise la cible, puis la charge explosive « frappe » pour former le lien covalent.
Les inhibiteurs covalents ne sont pas nouveaux. En fait, on les utilise pour traiter des maladies depuis plus d'un siècle, la pénicilline en étant l'un des premiers exemples. Les antibiotiques à base de pénicilline forment un lien covalent avec leur enzyme ciblée, inhibant ainsi la synthèse de la paroi bactérienne et entraînant une rupture de la membrane cellulaire. Un autre exemple bien connu est celui de l'aspirine, qui acétyle de manière irréversible une enzyme essentielle participant à la production de médiateurs de l'inflammation. Il est intéressant de noter que la découverte des mécanismes covalents de ces médicaments n'a été faite qu'une fois leur utilisation déjà largement répandue. En fait, bon nombre des inhibiteurs covalents majeurs ont été découverts par hasard plutôt que dans le cadre d'une conception rationnelle de médicaments.
Avantages des inhibiteurs covalents
Les inhibiteurs covalents présentent de multiples avantages. Alors que les inhibiteurs non covalents s'associent et se dissocient librement des enzymes, les inhibiteurs covalents forment des liens forts et durables avec leur cible. Cela leur permet de couper efficacement l'activité de la protéine ciblée pendant une longue période, offrant ainsi des effets thérapeutiques plus durables. Cette puissance renforcée permet d'administrer des médicaments à doses plus faibles et moins fréquemment, ce qui pourrait réduire le risque d'effets secondaires, renforcer la conformité et réduire les coûts de traitement.
En outre, les inhibiteurs covalents peuvent démontrer une sélectivité remarquable, engageant avec précision leurs cibles prévues. Cette propriété leur permet de cibler des protéines complexes qui présentent des difficultés pour les inhibiteurs non covalents, notamment celles qui ne disposent pas de poches de liaison classiques. En fait, les cibles autrefois considérées comme « inatteignables », comme le KRAS (la protéine oncogène aux mutations les plus fréquentes), peuvent désormais être visées avec succès par des inhibiteurs covalents. L'approbation du premier inhibiteur de KRAS, le sotorasib, a représenté un jalon majeur dans la gestion de cancers difficiles à traiter.
Inconvénients des inhibiteurs covalents
De nombreuses propriétés qui font des inhibiteurs covalents des thérapeutiques prometteuses peuvent aussi générer des inconvénients dans le développement de médicaments. Le caractère irréversible de la liaison exige que la liaison soit sélective. Toutefois, si la charge explosive n'est pas suffisamment sélective, le médicament risque de se lier à des protéines non visées, entraînant des effets non ciblés qui risquent de provoquer des dommages à long terme. En outre, certaines protéines ciblées peuvent muter ou subir des changements structurels qui empêchent l'inhibiteur covalent de se lier avec efficacité et de les inhiber. Cela peut aboutir au développement d'une résistance et réduire l'efficacité du médicament à long terme.
En raison de ces difficultés, la conception d'inhibiteurs covalents nécessite la prise en compte attentive de différents facteurs, tels que la réactivité de la charge explosive, la spécificité du site de liaison et la stabilité du lien covalent formé. Les groupes réactifs doivent respecter le « principe de Boucle d'or » : ils doivent être suffisamment réactifs pour former un lien avec une cible lors de la formation de complexes, mais pas au point de se lier à d'autres protéines ciblées ou à des groupes fonctionnels lorsqu'ils sont libres. Trouver le juste équilibre entre ces facteurs peut être une tâche complexe et fastidieuse.
L'avènement des thérapeutiques à inhibiteurs covalents
Les progrès de la technologie ont joué un rôle majeur dans l'accélération du développement d'inhibiteurs covalents. Un tournant crucial dans ce domaine est survenu lorsque les chercheurs ont commencé à se concentrer sur la covalence depuis les débuts du développement plutôt que de découvrir ce mécanisme par hasard.
Les chercheurs ont utilisé deux approches principales pour créer des thérapies efficaces à inhibiteurs covalents : la priorité au ligand et la priorité à l'électrophile. Les approches par priorité au ligand impliquent la conception de petites molécules capables de réagir à des résidus d'acides aminés spécifiques dans la protéine ciblée. À l'inverse, l'approche par priorité à l'électrophile se concentre sur la partie charge explosive du médicament, en identifiant les groupes d'électrophiles réactifs qui peuvent former des liens covalents avec des résidus nucléophiles dans la protéine ciblée.
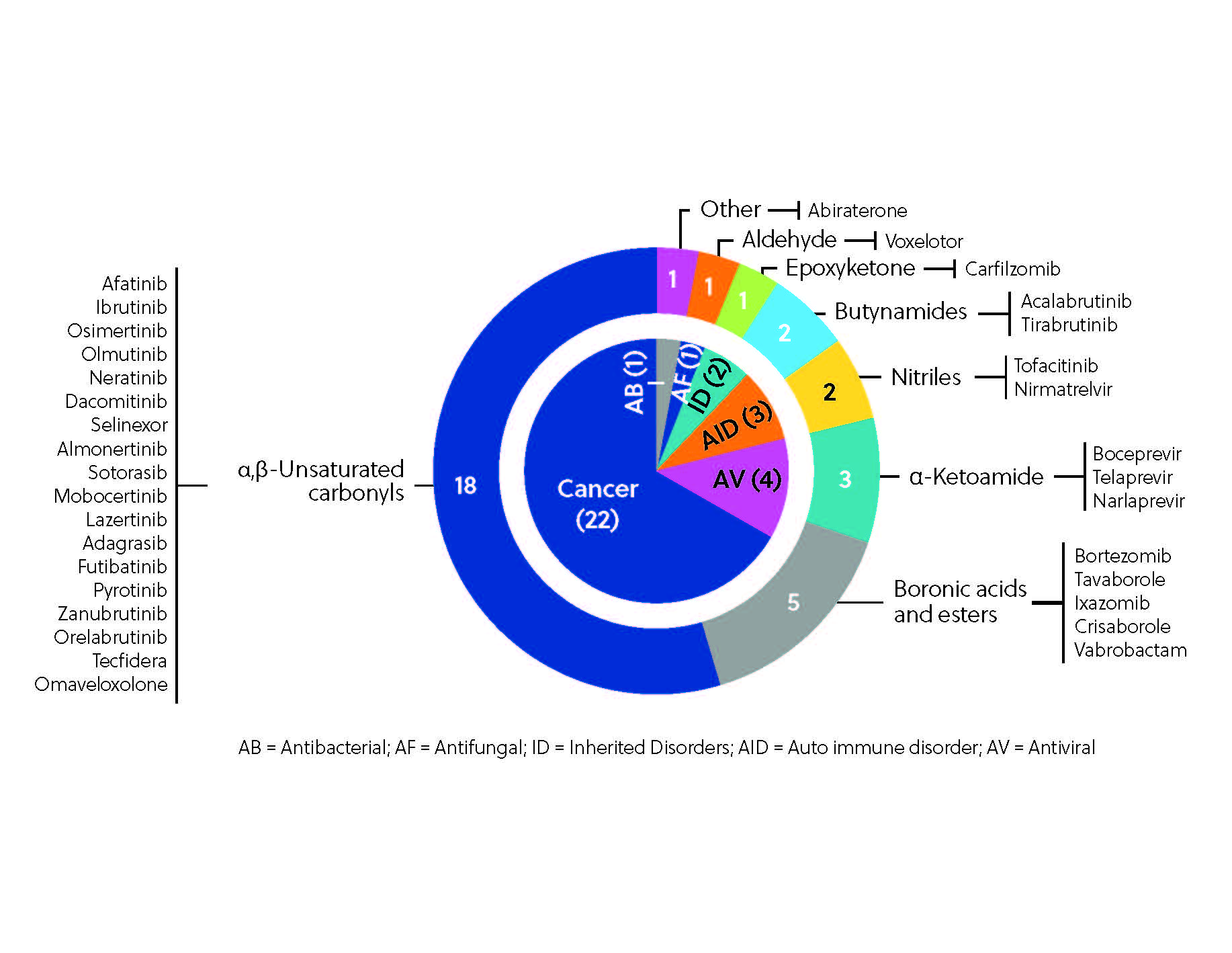
À ce jour, plus de 30 inhibiteurs covalents à travers le monde ont reçu une approbation réglementaire en tant que thérapeutiques (figure 3), le plus remarquable étant l'ibrutinib, dont nous avons déjà parlé, et qui figure dans la liste des 10 médicaments les plus vendus en 2021. L'ibrutinib fait partie des inhibiteurs de kinases notables découverts par le biais d'approches donnant la priorité au ligand, de même que l'afatinib, le dacomitinib et le nératinib.
Une autre application prometteuse des inhibiteurs covalents est leur aptitude à inhiber les protéases virales. Le nirmatrelvir (associé au ritonavir), un inhibiteur covalent réversible de la protéase MPRO du SARS-CoV-2, approuvé pour utilisation par la FDA aux États-Unis dans le traitement de la COVID-19, offre une option de traitement par voie orale très attendue pour les patients vulnérables. Le nirmatrelvir a été mis au point dans le cadre d'une approche donnant la priorité à l'électrophile par une adaptation structurellement guidée d'un inhibiteur covalent précédemment étudié.
Quelle est la prochaine étape pour les inhibiteurs covalents ?
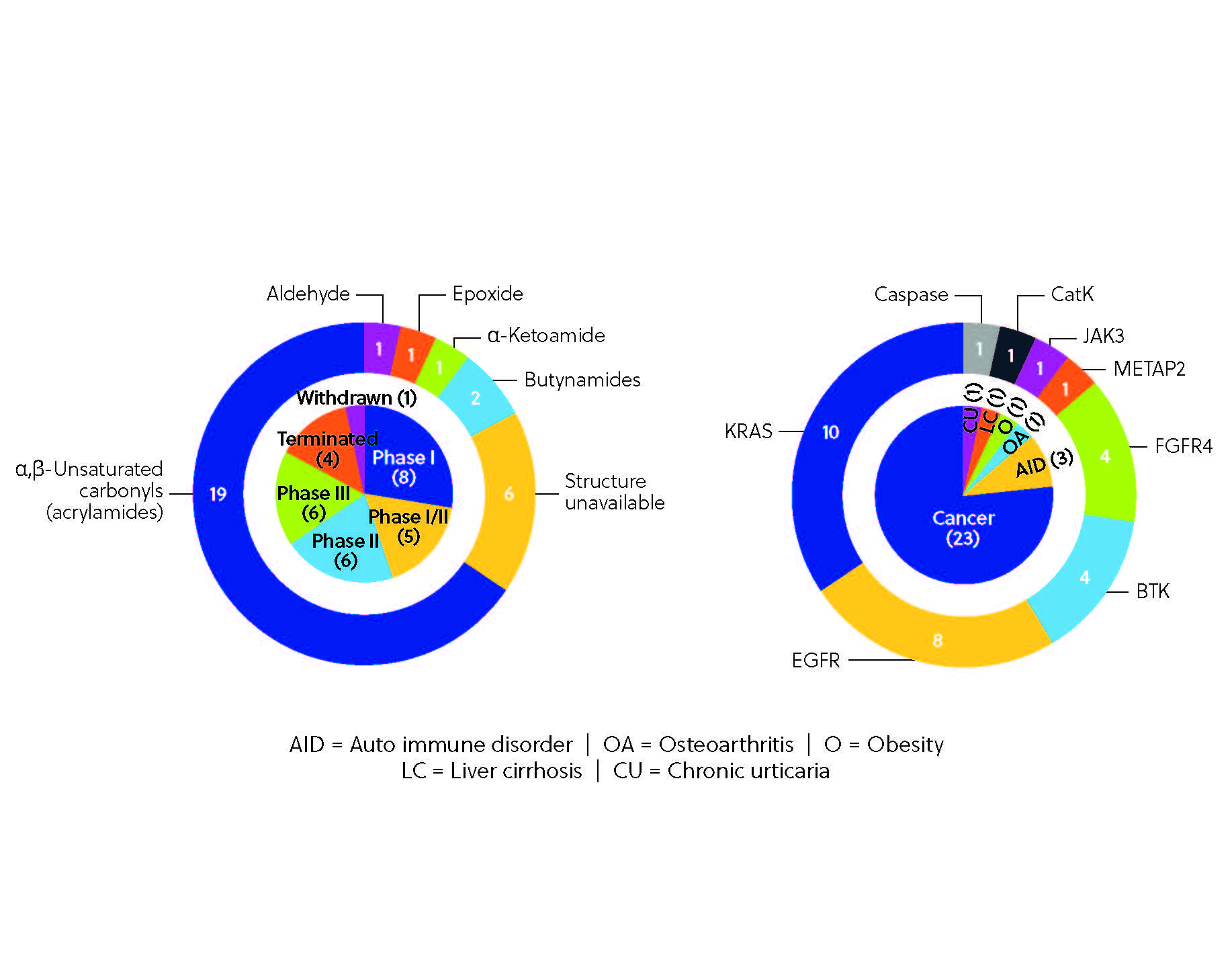
Le pipeline de développement clinique pour les inhibiteurs covalents offre un potentiel considérable. Plusieurs inhibiteurs covalents sont actuellement en phase d'essai clinique (figure 4), notamment le remibrutinib, un inhibiteur de la protéase BTK, le nazartinib, un inhibiteur de troisième génération de l'EGFR-TKI et le roblitinib, un inhibiteur sélectif de la FGFR4. Le pipeline est diversifié et de multiples protéines sont ciblées dans différents domaines thérapeutiques, des troubles auto-immuns comme la polyarthrite rhumatoïde et la pelade à des affections comme l'obésité et l'ostéoarthrite, même si les thérapies contre le cancer dominent toujours le pipeline. Cette diversité témoigne du potentiel réel de l'inhibition covalente, rendue possible par des outils et des techniques émergents, notamment les plateformes de sélection affinées et la recherche activée par la protéomique chimique. Ces technologies permettent aux chercheurs de faire une sélection dans de vastes bibliothèques de composés et de visualiser directement les interactions covalentes au sein du protéome. Grâce à ces innovations, on peut s'attendre à voir apparaître des inhibiteurs covalents toujours plus précis et puissants.
L'avènement des inhibiteurs covalents constitue un tournant dans le développement de médicaments. Leur aptitude à former des liens durables avec les protéines ciblées, alliée aux progrès technologiques, a ouvert la voie à une nouvelle ère de traitements. Alors que la recherche dans ce domaine continue de progresser, les inhibiteurs covalents sont porteurs de grandes promesses dans la révolution du traitement de différentes maladies et de l'amélioration de la vie des patients. Pour en savoir plus au sujet des inhibiteurs covalents et découvrir les tendances essentielles à suivre selon les experts, suivez notre webinaire ou lisez notre publication récente dans ChemRXiV.Pour lire des articles connexes au sujet du cancer, découvrez notre analyse approfondie du paysage des inhibiteurs de protéines RAS ou apprenez-en plus sur la dégradation ciblée des protéines et les colles moléculaires.