"Estamos inmersos en una revolución terapéutica", afirmaban los autores de un artículo de revisión publicado recientemente en Frontiers in Bioengineering and Biotechnology. Analizaban el rápido crecimiento de los tratamientos derivados de ARN en la investigación y el desarrollo clínico modernos, impulsado en parte por el interés que han despertado las vacunas de ARN para la COVID-19 durante la pandemia de SARS-CoV-2.
Tradicionalmente, el desarrollo de medicamentos ha estado dominado por los denominados "fármacos de moléculas pequeñas" (definidos como cualquier compuesto orgánico con un peso molecular bajo), que siguen teniendo numerosas aplicaciones médicas. Sin embargo, los avances en los campos de la biotecnología y la biología molecular han permitido a los investigadores diseñar agentes macromoleculares con potencial terapéutico que van desde los anticuerpos monoclonales y las proteínas recombinantes a los oligonucleótidos y genes o fragmentos de genes. Como resultado, los "productos biológicos" se han convertido en componentes esenciales del arsenal terapéutico disponible en la actualidad. Ya en 2020, siete de los diez medicamentos más vendidos en todo el mundo fueron productos biológicos.
Además, ha entrado en escena el diseño de medicamentos a base de ácidos nucleicos, que en la actualidad está experimentando una rápida expansión. Aunque el desarrollo clínico de tratamientos a base de ARN se ha visto obstaculizado en el pasado por algunos problemas, como los relacionados con la eficiencia y la inmunogenicidad, el éxito reciente de las vacunas de ARNm para la COVID-19 y la aprobación de varios medicamentos derivados del ARN han supuesto un importante espaldarazo para este campo. Hemos usado la CAS Content Collection™ —la mayor recopilación de conocimiento científico publicado seleccionada por expertos— para examinar la aplicación del ARN en la medicina moderna.
Lea el informe de CAS Insights relacionado: Medicamentos derivados del ARN: un repaso a las tendencias y los avances de la investigación.
Ventajas y problemas de los tratamientos derivados del ARN
A la caza de dianas sin afinidad farmacológica
Una de las grandes ventajas de los tratamientos derivados del ARN es que los medicamentos basados en el ARN pueden actuar sobre moléculas que tienen una afinidad baja o nula por los fármacos de moléculas pequeñas. Solo alrededor de un quinto de las proteínas son dianas viables para los fármacos de uso común, como las moléculas pequeñas y los anticuerpos, y no es posible actuar sobre los ARN no codificantes usando moléculas pequeñas tradicionales o anticuerpos monoclonales (que se unen a los bolsillos de los sitios activos de enzimas o receptores de proteínas, para lo que debe haberse producido una traducción).
Simplificación de la síntesis
Los productos derivados del ARN pueden presentar importantes ventajas con respecto a las proteínas en cuanto a la sencillez, la rentabilidad y la velocidad de los procesos de fabricación, algo que ha sido esencial para el desarrollo de las vacunas de ARN recientes. Además, las estrategias basadas en ácidos nucleicos hacen innecesarios algunos procesos de síntesis complejos, como las modificaciones posteriores a la traducción, usando la maquinaria celular de las células de los mamíferos.
Por otra parte, la secuencia de ARN se puede ajustar rápidamente, lo que produce moléculas adaptadas a diferentes dianas. Esto agiliza enormemente el proceso de desarrollo, como se ha podido comprobar con las vacunas de ARN para la COVID-19.
Seguridad y efectos secundarios
Como entran dentro del núcleo, los medicamentos basados en el ADN plantean dudas de seguridad por su potencial integración en el genoma del anfitrión. Salvo los ARN del sistema CRISPR-Cas que editan el genoma, los ARN no alteran el material genómico y no presentan ningún riesgo de integración genómica.
Sin embargo, los tratamientos derivados del ARN pueden plantear problemas de especificidad que crean cierto riesgo de efectos secundarios y su susceptibilidad a la degradación puede dar como resultado una farmacodinámica deficiente que complica su uso. Algunos de estos problemas se pueden mitigar modificando químicamente el ARN, un tema en el que se han centrado diversas investigaciones.
Administración
Los fármacos derivados del ARN suelen tener un tamaño mayor que los de moléculas pequeñas y tienen, además, una carga eléctrica elevada, lo que dificulta su administración intracelular en sus formas naturales.
Tendencias de la investigación en los tratamientos derivados del ARN
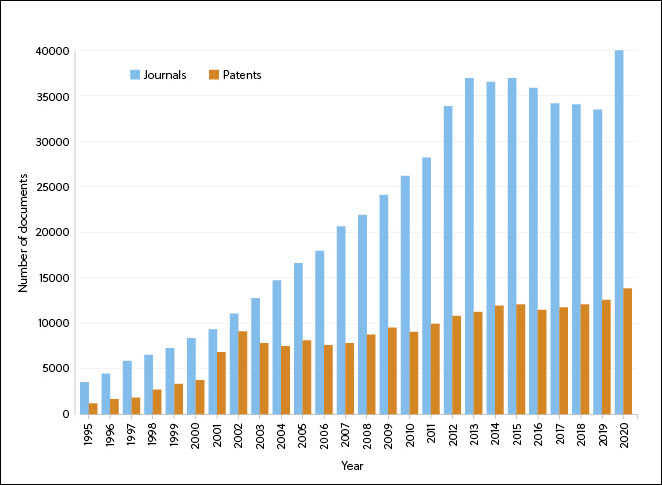
Desde 1995 se ha producido un aumento gradual en el número de revistas y patentes que contienen información sobre tratamientos derivados del ARN, con un pico en el número de pacientes en torno a 2001 (posiblemente relacionado con el primer ensayo clínico en humanos en el que se usaron células dendríticas transfectadas con ARNm que codificaba antígenos tumorales) y otro pico en el número de revistas en 2020 (probablemente asociado al interés por las vacunas de ARNm para la COVID-19) (figura 1).
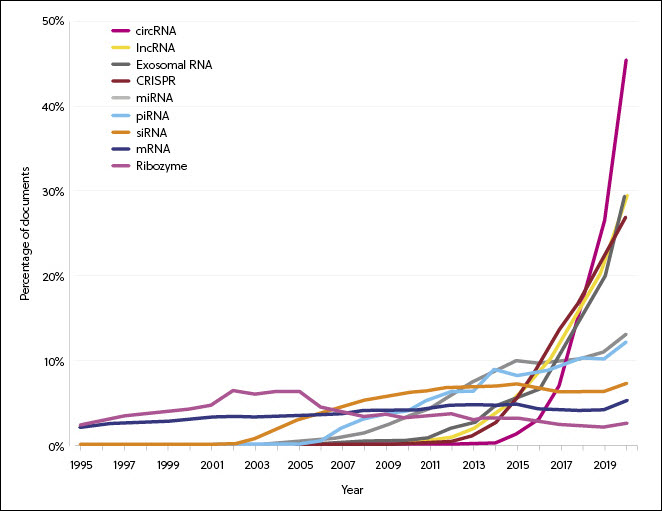
La investigación del ARN se ha ido diversificando a medida que se descubrían nuevos tipos de ARN, en especial en las áreas del ARN interferente pequeño (siRNA), el microARN (miRNA), el ARN largo no codificante (lncRNA) y la tecnología CRISPR (figura 2). Las tasas de aumento de los volúmenes de publicaciones relacionadas con el ARN circular (circRNA), el ARN de exosoma, el ARN largo no codificante y CRISPR son considerablemente más altas que las del resto. La tecnología CRISPR representó el 20 % de todas las solicitudes de patentes relacionadas con el ARN en el 2020. Esto coincide con un número creciente de aprobaciones para que los tratamientos basados en CRISPR se estudien en ensayos clínicos.
Interferir en el funcionamiento de los nuevos tipos de ARN se considera una herramienta terapéutica prometedora para resolver los problemas de las estrategias terapéuticas tradicionales (tabla 1).
| Tipo de ARN | Funciones terapéuticas |
| ARN mensajero (ARNm) | El principio básico de los tratamientos basados en el ARNm es la administración del ARNm transcrito in vitro en una célula en la que el ARNm se traduce en una proteína funcional, como los anticuerpos, los antígenos y las citoquinas. |
| ARN interferente pequeño (siRNA) | Mediante la degradación selectiva del ARNm, el ARN interferente pequeño participa en el silenciamiento de genes de determinadas secuencias en la patogénesis de diversas enfermedades asociadas con un origen genético conocido. |
| MicroARN (miRNA) | El microARN puede alterar la expresión de varios genes distintos de manera simultánea interviniendo en la degradación selectiva del ARNm o la represión de la traducción del ARNm. |
| ARN largo no codificante (IncRNA) | Los ARN largos no codificantes son un grupo grande de genes de ARN estructuralmente complejos que pueden interactuar con el ADN, con el ARN o con moléculas de proteínas (histonas) para regular la transcripción genética por medio de modificaciones epigenéticas (principalmente, la metilación y la acetilación). |
| ARN circular (circRNA) | Los ARN circulares pueden aislar proteínas o traslocar proteínas entre compartimentos subcelulares. La desregulación de los ARN circulares se ha relacionado con diversas enfermedades, en especial neoplasias malignas, enfermedades cardiovasculares y enfermedades neurológicas. Para diferentes tejidos o células, las estrategias de ganancia de función y pérdida de función se suelen llevar a cabo usando la expresión del ARN circular. |
| ARN asociado a Piwi (piRNA) | Los ARN asociados a Piwi se pueden unir a proteínas Piwi para formar un complejo piRNA/Piwi e influir en el silenciamiento de los transposones, la espermiogénesis, el reordenamiento del genoma, la regulación epigenética, la regulación de proteínas y el mantenimiento de células madre germinales. |
| Ribozima | Las enzimas de ARN o ribozimas son moléculas de ARN con capacidad catalítica que reconocen secuencias concretas del ARN objetivo con un alto grado de especificidad para reducir la expresión de los genes patogénicos y repararlos. Por tanto, se pueden usar para tratar diversas enfermedades que van desde desórdenes metabólicos congénitos a infecciones víricas y enfermedades adquiridas como el cáncer. |
| ARN de exosoma | Los exosomas son un típo de nanovesícula extracelular que se puede emplear para el diagnóstico o el tratamiento de diversas patologías. Actualmente se está investigando el potencial de la detección del ARN de exosoma en el diagnóstico clínico. Con fines terapéuticos, la administración de ARN pequeño contenido en exosomas se usa como herramienta potente y específica de silenciamiento de genes tras la transcripción mediante una degradación catalítica o una interrupción de la traducción del ARN objetivo. |
| CRISPR | El sistema CRISPR-Cas9 es una de las tecnologías de edición de secuencias genéticas más versátiles y eficientes, y se puede usar para editar el genoma, investigar las funciones de los genes y diseñar genoterapias. Hasta la fecha, la tecnología CRISPR-Cas9 se ha usado extensamente en el tratamiento de enfermedades genéticas, como la distrofia muscular de Duchenne, la deficiencia de α1-antitripsina, la hemofilia, la hipoacusia y las enfermedades hematopoyéticas. |
¿En qué áreas terapéuticas se están empleando los tratamientos derivados del ARN?
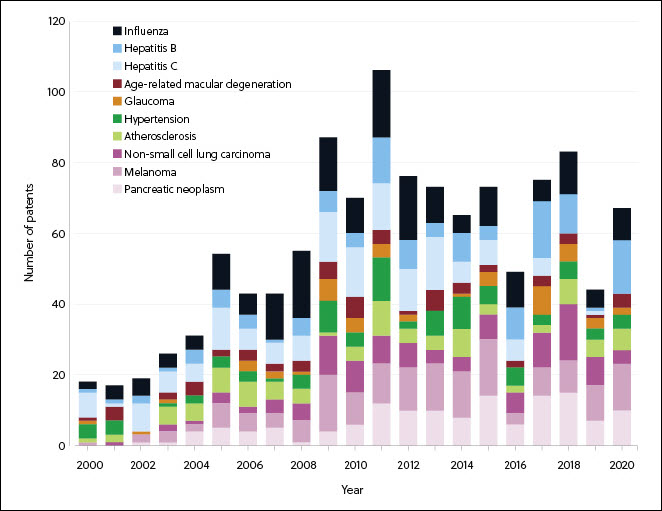
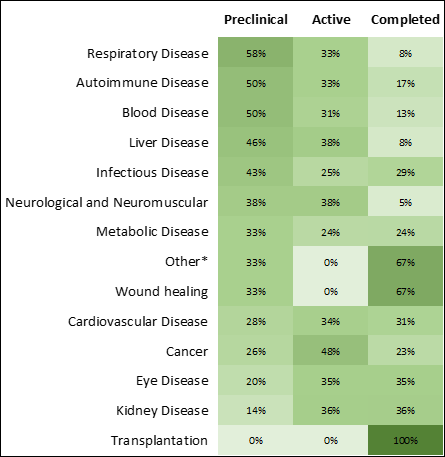
Las enfermedades infecciosas y el cáncer han registrado el mayor crecimiento y el número más alto de tratamientos en fase de investigación (figuras 3 y 4). La pandemia de COVID-19 ha multiplicado los medicamentos derivados del ARN para enfermedades infecciosas que están en fase de investigación y el número de tratamientos aprobados (figura 4), y ha hecho posible la llegada al mercado de los primeros tratamientos de ARNm aprobados.
Soluciones para los problemas de los tratamientos derivados del ARN
La modificación química del ARN se puede usar para protegerlo frente a la degradación y mejorar la especificidad, reduciendo así el riesgo de efectos secundarios no deseados. Además de la modificación química, los vehículos de administración integrados por nanomateriales se pueden usar para proteger el ARN frente a la degradación y facilitar el transporte del tratamiento a la ubicación deseada.
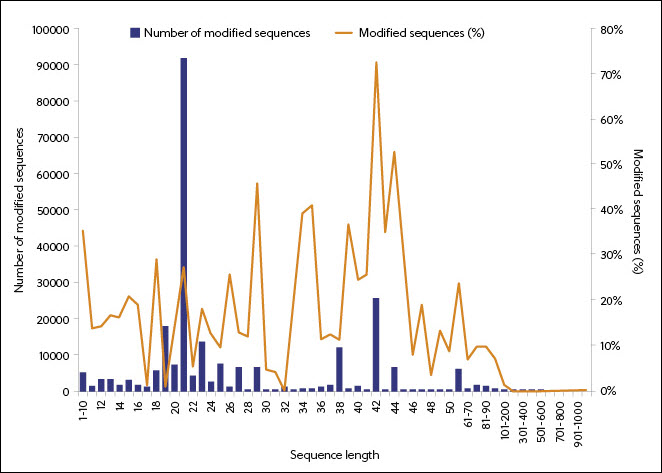
Según los datos de la CAS Content Collection, el uso de la modificación del ARN empezó a despegar en 1995 y está asociado a secuencias de longitudes más cortas (figura 5). El predominio de los ARN con los nucleótidos 18-27 modificados refleja el uso de esta longitud de secuencia en algunas formas concretas de ARN (como el ARN interferente pequeño [siRNA] y los oligonucleótidos no codificantes [ASO]). El examen de las modificaciones de los medicamentos derivados del ARN aprobados por la FDA confirma la correlación entre el tipo de ARN y sus modificaciones.
Modificaciones de las bases del ARN
Los nucleótidos no canónicos con modificaciones que interfieren en la formación de enlaces de hidrógeno pueden desestabilizar térmicamente la formación de una doble cadena con la diana para mejorar la especificidad y limitar las uniones no deseadas. Además, la modificación puede mejorar la eficacia del ARN terapéutico. El uso de la base modificada N1-metilpseudouridina en los ARNm terapéuticos, por ejemplo, en las vacunas de ARNm para la COVID-19, mejora la traducción y reduce los efectos secundarios citotóxicos y la respuesta inmunitaria al ARNm. Tanto la vacuna Comirnaty de Pfizer como la Spikevax de Moderna (ambas de ARNm) usan también caperuzas de 7-metilguanosina unidas mediante 5’ trifosfato al extremo 5’ del ARNm, lo que duplica las caperuzas de ARNm presentes en la naturaleza que impiden la degradación del extremo 5’ del ARNm.
Modificaciones de la ribosa
Las modificaciones de la posición 2’ de la ribosa en el ARN pueden incrementar la estabilidad y reducir los efectos no deseados. Las modificaciones más comunes en la posición 2’ son 2’-O-metil, 2’-fluoro, 2’-O-metoxietil (MOE) y 2’-amina.
Modificaciones del esqueleto
Las modificaciones del grupo fosfato del esqueleto de azúcar-fosfato pueden mejorar la administración del ARN neutralizando la carga negativa que puede interferir en el transporte a través de las membranas e incrementan la resistencia a las nucleasas, lo que aumenta la semivida de eliminación en un tejido. Una de las modificaciones del esqueleto más usadas es el fosforotioato.
Investigaciones relacionadas con nanoportadores de ARN
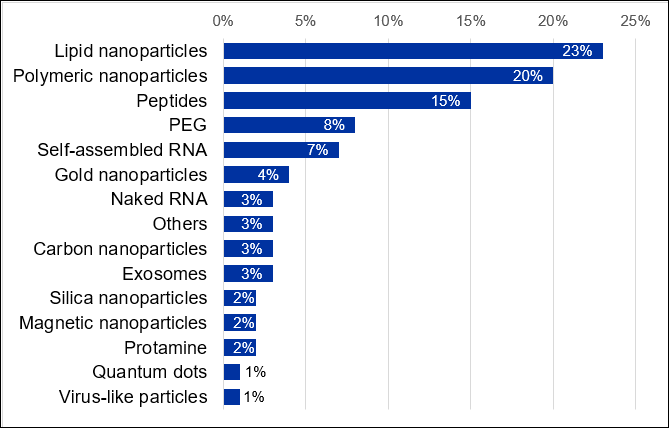
Aunque algunas barreras biológicas como la inmunogenicidad y la estabilidad de la nucleasa se suelen abordar modificando la estructura química del ARN, se necesitan otros sistemas de administración para superar otras barreras del organismo. La encapsulación del ARN en nanopartículas es una forma eficaz de proteger y administrar el ARN. Actualmente, hay cerca de 7000 publicaciones científicas relacionadas con los sistemas de administración de ARN en la CAS Content Collection. Entre los estudios relacionados con los portadores de ARN, predominan los dedicados a las nanopartículas lipídicas, seguidos a corta distancia por los de los nanoportadores poliméricos (figura 6).
Conclusiones
Los medicamentos derivados del ARN están experimentando un rápido crecimiento y podrían cambiar los tratamientos de referencia para muchas enfermedades. Presentan algunas ventajas con respecto a los medicamentos tradicionales a base de moléculas pequeñas y moléculas biológicas, ya que son rentables y relativamente fáciles de fabricar y pueden actuar sobre dianas que hasta la fecha no presentaban afinidad por ningún fármaco. Los problemas clásicos relacionados con la estabilidad, la administración y los efectos no deseados se pueden eliminar o reducir con la ayuda de modificaciones químicas y nanoportadores de ARN. Una búsqueda en la CAS Content Collection ha permitido ver que algunas enfermedades infecciosas (como la COVID-19) y el cáncer están entre las áreas terapéuticas más importantes para el ARN y ha mostrado que las tasas de aumento de los volúmenes de publicaciones sobre el circRNA, el ARN de exosoma, el lncRNA y la tecnología CRISPR son especialmente altas, con una importante explosión reciente de las investigaciones relacionadas con CRISPR.
Hablan los expertos
Si desea obtener más información, vea el seminario web reciente de ACS para descubrir las áreas que más interesan a los líderes del desarrollo de tratamientos derivados del ARN. En este debate participan expertos de diversos campos de investigación, como:
- Dr. John P. Cooke, director médico del Center for RNA Therapeutics
- Dr. Robert DeLong, profesor titular del Nanotechnology Innovation Center de la Universidad Estatal de Kansas
- Dra. Barb Ambrose, científica sénior especializada en información de CAS
- Dr. Ramana Doppalapudi, vicepresidente de Química en Avidity Biosciences
- Moderado por el Dr. Gilles Georges, vicepresidente y director científico de CAS