Obtenez de nouvelles perspectives pour une progression plus rapide directement dans votre boîte de réception.
Le microbiome intestinal, un organe supplémentaire du corps humain
Le corps humain abrite une grande variété de micro-organismes, principalement des bactéries, mais aussi des virus, des protozoaires, des champignons et des archées. Ils sont collectivement connus sous le nom de microbiome. Le microbiote intestinal, la flore intestinale ou le microbiome sont les micro-organismes qui vivent dans le tube digestif des humains et des autres animaux. Si certaines bactéries sont associées à des maladies, d'autres sont particulièrement importantes pour de nombreux aspects de la santé. En fait, le corps humain contient plus de cellules bactériennes que de cellules humaines - environ 40 000 milliards de cellules bactériennes contre seulement 30 000 milliards de cellules humaines. Ces microbes peuvent peser à peu près autant que le cerveau. Ensemble, ils fonctionnent comme un organe supplémentaire dans le corps humain et jouent un rôle énorme dans la santé humaine. Le génome collectif du microbiome intestinal représente plus de 100 fois la quantité d'ADN humain dans le corps. Compte tenu de cet énorme potentiel génétique du microbiote, il jouerait un rôle dans pratiquement tous les processus physiologiques du corps humain. Les bactéries intestinales ont été associées à plusieurs maladies mentales, et on a constaté que les patients souffrant de divers troubles psychiatriques tels que la dépression, les troubles bipolaires, la schizophrénie et l'autisme présentaient des altérations significatives de la composition de leurs micro-organismes intestinaux.
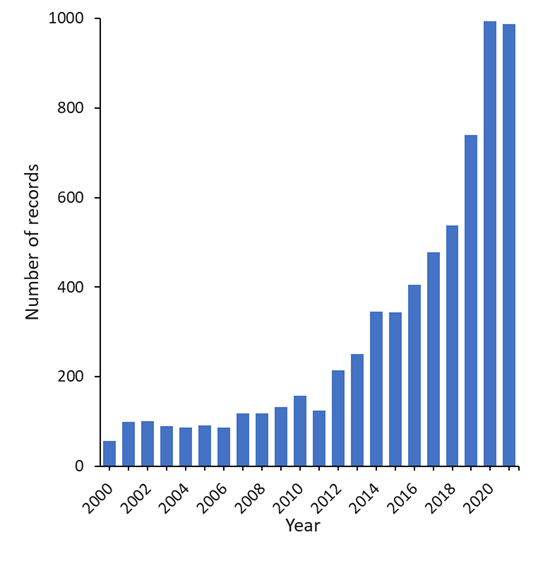
L'intérêt pour le microbiome intestinal en relation avec la santé humaine, et plus particulièrement avec la santé mentale, a augmenté de manière exponentielle depuis l'an 2000, comme le montre une recherche dans CAS Collection de contenusTM. Actuellement, il existe plus de 7 000 publications sur le microbiome intestinal en relation avec la santé mentale (figure 1).
Les bébés acquièrent leur première dose de microbes à la naissance. Développement du microbiome intestinal humain
On pense généralement que l'utérus est un environnement stérile et que la colonisation bactérienne commence à la naissance. Le microbiome d'un nouveau-né varie en fonction du mode d'accouchement : le microbiome des nourrissons nés par voie basse ressemble au microbiome vaginal maternel, tandis que celui des nourrissons nés par césarienne ressemble au microbiome cutané maternel. Divers autres facteurs influencent le développement du microbiome néonatal, comme la naissance prématurée et le mode d'alimentation. Le principal déterminant de la composition du microbiome intestinal à l'âge adulte semble être l'alimentation. Des changements rapides dans la composition du microbiome se produisent en réponse à des modifications de l'apport alimentaire. Des tendances caractéristiques sont perceptibles dans les régimes à base de plantes par rapport aux régimes à base de protéines animales. Le développement et l'altération du microbiome intestinal sont également influencés par de multiples autres facteurs. L'exposition au stress est le deuxième facteur le plus important (après l'alimentation) qui affecte la composition du microbiome intestinal, selon une recherche effectuée dans CAS Collection de contenus. Les autres facteurs sont les suivants : le mode d'accouchement et la méthode d'alimentation du nourrisson, les conditions environnementales, les médicaments, le stade et le mode du cycle de vie, les comorbidités et les procédures médicales (figure 2). Une perturbation de l'homéostasie du microbiote causée par un déséquilibre de sa composition fonctionnelle et de ses activités métaboliques, ou une modification de sa distribution locale, est appelée dysbiose, indiquant un déséquilibre ou une inadaptation microbienne.

Compte tenu du rôle significatif désormais reconnu de l'alimentation sur la composition du microbiome intestinal, et de l'impact vital du microbiome intestinal sur la santé, la question à un million de dollars demeure : quel régime alimentaire est bénéfique et donc recommandable pour satisfaire nos bactéries intestinales ? Bien qu'il n'existe pas de réponse définitive et sans ambiguïté désignant certains aliments comme remèdes spécifiques à une maladie, certaines grandes lignes directrices ont été définies. Un régime riche en fibres affecte particulièrement le microbiote intestinal. Les fibres alimentaires ne peuvent être digérées et fermentées que par les enzymes du microbiote vivant dans le côlon. Les acides gras à chaîne courte sont libérés en raison de la fermentation, ce qui abaisse le pH du côlon. L'environnement très acide détermine le type de microbiote qui survivrait. Le pH plus faible limite la croissance de certaines bactéries nocives comme les Clostridioides difficiles. Les aliments riches en fibres tels que l'inuline, les amidons, les gommes à mâcher, les pectines et les fructo-oligosaccharides sont connus sous le nom de prébiotiques car ils nourrissent notre microbiote bénéfique. En général, on trouve de grandes quantités de ces fibres prébiotiques dans les fruits, les légumes, les haricots et les céréales complètes comme le blé, l'avoine et l'orge. Une autre catégorie d'aliments très bénéfiques comprend des probiotiques, des bactéries vivantes qui sont bonnes pour le système digestif et peuvent modifier davantage notre microbiome intestinal. Il s'agit notamment des aliments fermentés tels que le kéfir, le yaourt avec des ferments actifs vivants, les légumes marinés, le thé kombucha, le kimchi, le miso et la choucroute.
Participants au microbiote intestinal
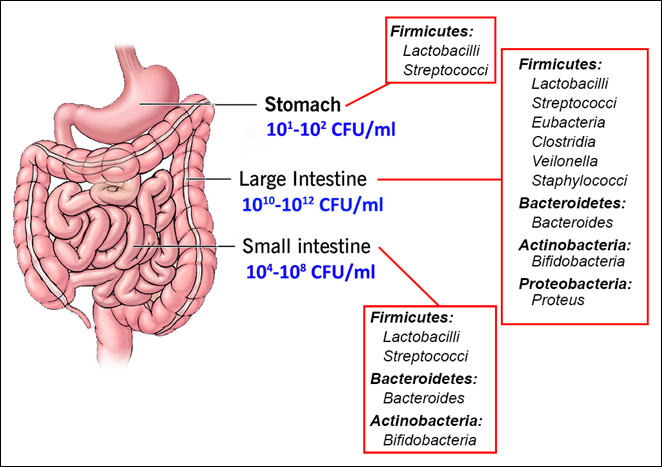
Le microbiote intestinal humain est divisé en plusieurs groupes appelés phyla. Le microbiote intestinal comprend principalement quatre phyla principaux, à savoir les Firmicutes, les Bacteriodetes, les Actinobactéries et les protéobactéries. Les Firmicutes et les Bacteroidetes représentent 90 % du microbiote intestinal. La majorité des bactéries réside dans le tractus gastro-intestinal, la plupart des bactéries anaérobies étant logées dans le gros intestin (figure 3).
L'axe intestin-cerveau : le microbiome intestinal en tant que « deuxième cerveau ».
Il est désormais bien établi que l'intestin et le cerveau sont en communication bidirectionnelle constante, dont le microbiote et sa production métabolique sont une composante majeure. Michael Gershon a qualifié le système digestif de « deuxième cerveau » dans son livre de 1999, à l'époque où les scientifiques commençaient à réaliser que l'intestin et le cerveau chez l'homme étaient engagés dans un dialogue constant et que les microbes intestinaux modulent de manière significative les fonctions cérébrales.
Il est désormais communément admis que le microbiote intestinal communique avec le système nerveux central par des voies neurales, endocriniennes et immunitaires, et qu'il contrôle ainsi le fonctionnement du cerveau. Des études ont démontré que le microbiote intestinal joue un rôle important dans la régulation de l'anxiété, de l'humeur, des facultés intellectuelles et de la douleur. Ainsi, le concept émergent d'un axe microbiote-intestin-cerveau suggère que la modulation du microbiote intestinal pourrait être une stratégie efficace pour développer de nouvelles thérapies contre les troubles du système nerveux central.
Microbiote intestinal et COVID-19
Récemment, une corrélation a été signalée entre la composition du microbiote intestinal et les niveaux de cytokines et de marqueurs inflammatoires chez les patients atteints par la COVID-19. Il est suggéré que le microbiome intestinal est impliqué dans l'ampleur de la sévérité de la COVID-19 via la modulation des réponses immunitaires de l'hôte. De plus, la dysbiose du microbiote intestinal pourrait contribuer à la persistance des symptômes même après la résolution de la maladie, ce qui souligne la nécessité de comprendre comment les micro-organismes intestinaux sont impliqués dans l'inflammation et la COVID-19.
Métabolites neuroactifs microbiens intestinaux
Les anomalies de l'axe microbiote intestinal-cerveau sont apparues comme un facteur clé dans la physiopathologie des maladies neuronales. C'est pourquoi de plus en plus de recherches sont consacrées à la compréhension du potentiel neuroactif des produits du métabolisme microbien intestinal. Ainsi, les principaux métabolites microbiens intestinaux neuroactifs sont apparus comme suit.
Neurotransmetteurs
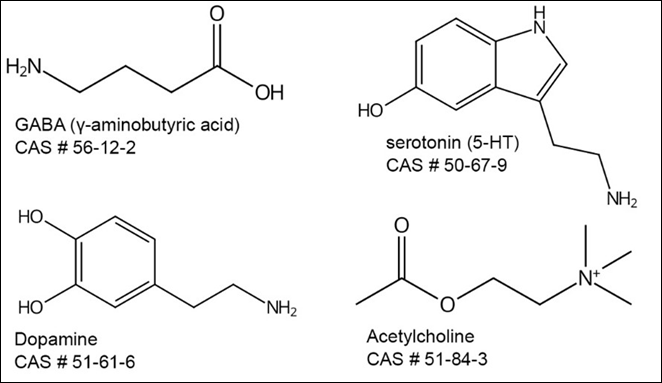
Le microbiome intestinal produit des neurotransmetteurs qui régulent l'activité cérébrale. La majorité des neurotransmetteurs du système nerveux central sont également présents dans le tractus gastro-intestinal, où ils exercent des effets locaux tels que la modulation de la motilité intestinale, la sécrétion et la signalisation cellulaire. Les membres du microbiote intestinal peuvent synthétiser des neurotransmetteurs : par exemple, les Lactobacilles et les Bifidobactéries produisent du GABA ; l'Escherichia coli produit de la sérotonine et de la dopamine ; les Lactobacilles produisent de l'acétylcholine. (Figure 4) Ils envoient un signal au cerveau via le nerf vague.
Acides gras à chaîne courte
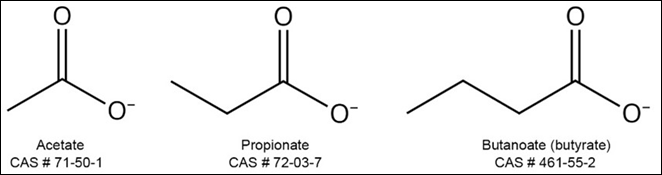
Les acides gras à chaîne courte sont de petits composés organiques produits dans le cæcum et le côlon par la fermentation anaérobie des glucides alimentaires qui nourrissent d'autres bactéries et sont facilement absorbés dans le gros intestin. Les acides gras à chaîne courte sont impliqués dans les fonctions du système digestif, du système immunitaire et du système nerveux central, mais il existe différents points de vue concernant leur impact sur le comportement. Les trois acides gras à chaîne courte les plus abondants produits par le microbiome intestinal sont l'acétate, le butyrate et le propionate (figure 5). Il a été démontré que leur administration atténuait les symptômes de la dépression chez les souris. Les bactéries anaérobies gram-positives qui fermentent les fibres alimentaires pour produire des acides gras à chaîne courte sont les bactéries Faecalibacterium et Coprococcus. Les Faecalibacteria sont des microbes intestinaux abondants qui jouent un rôle immunologique important et présentent un intérêt clinique pour diverses maladies, dont la dépression.
Métabolites du tryptophane
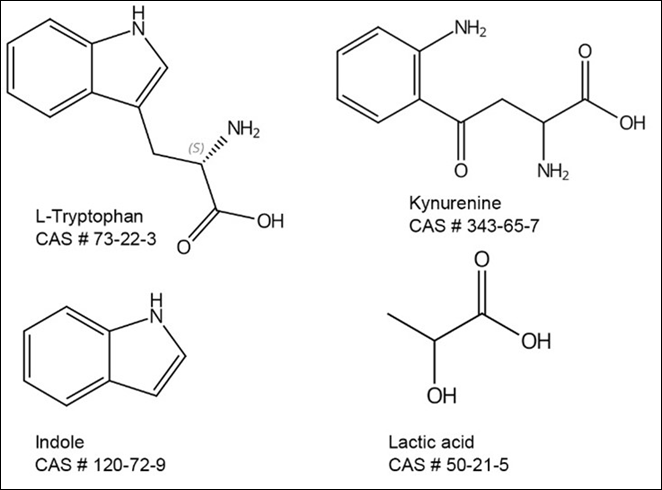
Le tryptophane est un acide aminé essentiel participant à la synthèse des protéines. Sa dégradation métabolique par des enzymes bactériennes (tryptophanase) donne naissance à des molécules neuroactives aux propriétés modulatrices de l'humeur établies, notamment la sérotonine, la kynurénine et l'indole (figure 6). On a constaté que l'apport alimentaire en tryptophane peut moduler les concentrations de sérotonine dans le système nerveux central chez l'homme, et que la déplétion en tryptophane aggrave la dépression.
Acide lactique
L'acide lactique (figure 6) est un acide organique provenant principalement de la fermentation de fibres alimentaires par des bactéries lactiques (par exemple, L. lactis, L. gasseri et L. reuteri), des bifidobactéries et des protéobactéries. Les lactates peuvent être convertis par plusieurs espèces bactériennes en acides gras à chaîne courte contribuant au pool total d'acides gras à chaîne courte. L'acide lactique est absorbé dans la circulation sanguine et peut traverser la barrière hémato-encéphalique. L'acide lactique joue un rôle bien connu dans la signalisation du système nerveux central dans le cerveau. En raison de sa capacité à être métabolisé en glutamate, il est utilisé comme substrat énergétique par les neurones. Il contribue également à la plasticité synaptique et déclenche le développement de la mémoire.
Vitamines
La plupart des bactéries de l'intestin, telles que le Lactobacillus et la Bifidobacterium, synthétisent des vitamines (notamment du groupe des vitamines B et de la vitamine K) dans le cadre de leur métabolisme dans le gros intestin. L'être humain dépend du microbiote intestinal pour la production de vitamines. Les vitamines sont des micronutriments essentiels qui jouent un rôle omniprésent dans une multitude de processus physiologiques du corps humain, y compris du cerveau. Des transporteurs actifs leur font traverser la barrière hémato-encéphalique. Dans le système nerveux central, leur rôle s'étend de l'homéostasie énergétique à la production de neurotransmetteurs. Les carences en vitamines peuvent avoir un effet négatif important sur la fonction neurologique. L'acide folique (vitamine B9) est une vitamine d'origine microbienne qui a été largement impliquée dans la pathologie de la dépression.
Perspectives
Un traitement novateur récent, la transplantation de microbiote fécal, a été testé lors d'essais cliniques et s'est avéré extrêmement prometteur sur le plan thérapeutique. Au cours des cinq dernières années, environ 1 000 documents relatifs aux transplantations fécales ont été inclus chaque année dans la Collection de contenus CAS. Par exemple, il a été signalé que la transplantation de microbiote fécal est capable de résoudre 80 à 90 % des infections causées par des Clostridioides difficiles récurrents qui ne répondent pas aux antibiotiques. Les implications uniques pour les essais cliniques utilisant les transplantations de microbiote fécal, qui sont de plus en plus étudiées comme traitements potentiels pour une série de maladies, doivent être rapidement explorées.
À l'heure actuelle, la recherche sur la modulation de l'axe intestin-cerveau par le microbiote gastro-intestinal est une science émergente, innovante et de pointe. Une grande partie des données disponibles est basée sur la science fondamentale ou sur des modèles animaux qui ne sont pas forcément adaptables à des interventions efficaces chez l'homme. Par conséquent, les prescriptions individualisées de composés prébiotiques et de souches probiotiques spécifiques qui représenteraient l'idéal pour la personnalisation de la médecine de la nutrition et du mode de vie restent un espoir. Les efforts en cours pour caractériser davantage les fonctions du microbiome et les mécanismes qui sous-tendent les interactions hôte-microbe permettront de mieux comprendre le rôle du microbiome dans la santé et les maladies.
Pour en savoir plus sur la façon dont les tendances émergentes et les nouvelles approches aident les millions de personnes qui souffrent de dépression, d'anxiété et de TSPT, consultez notre blog sur les psychédéliques et leurs progrès en tant qu'approche thérapeutique.