
En ce jour anniversaire de l'un des accidents industriels les plus importants et les plus dévastateurs de l'histoire, nous nous souvenons de la tragédie de Beyrouth, une explosion si énorme qu'elle a été entendue à 200 km de là, sur l'île de Chypre. L'épicentre de la détonation était un entrepôt sur le port et le carburant était constitué par 2 750 tonnes de nitrate d'ammonium.
Le nitrate d'ammonium est l'un des engrais les plus largement utilisés, un composant majeur de nombreux autres composés industriels comme les explosifs utilisés dans les mines, et servant aussi de nutriment pour produire des antibiotiques et des levures. Comme tant d'autres produits chimiques utilisés dans des processus industriels, il présente un risque qui peut être atténué par des procédures solides de stockage et de manutention sécurisés.
Les enquêtes sont encore en cours à Beyrouth, mais on pense qu'un incendie s'est déclaré dans un entrepôt du port et s'est propagé dans une zone où du nitrate d'ammonium était stocké ; un stockage non sécurisé à proximité de fusées pyrotechniques et sans mesures d'isolation ou de prévention d'incendie aurait entraîné son explosion. En l'espace de quelques secondes, cet accident a tué plus de 200 personnes, fait plus de 5 000 blessés et laissé environ 300 000 personnes sans abri. Malheureusement, cet événement n'était pas unique, et les incendies causés par des produits chimiques, comme le nitrate d'ammonium, sont encore trop fréquents. Finalement, si une substance est capable de libérer rapidement de l'énergie, elle présente un risque d'explosion ou d'incendie potentiel. Mais pourquoi certains produits chimiques possèdent-ils de telles caractéristiques ?
Des liaisons chimiques faibles et des produits stables forment un ensemble explosif
Si une substance possède des liaisons chimiques faibles, en particulier si elle contient des produits stables, elle est susceptible de présenter un risque d'incendie ou d'explosion. Les carburants, comme l'essence, brûlent parce que leur combustion produit des substances stables avec des liaisons chimiques plus fortes ; dans le cas de l'essence, ces produits sont le dioxyde de carbone et l'eau. L'essence nécessite soit de la chaleur, soit une source d'allumage, comme une étincelle ou une flamme pour brûler, car les liaisons dans les réactifs du carburant ne sont pas faciles à briser.
Par exemple, la figure 1 présente un modèle conceptuel d'une réaction comme la combustion de l'essence. La ligne violette indique comment l'énergie libre se transforme de réactifs en produits pendant une réaction. Lorsque l'essence brûle, elle forme des produits stables (eau et dioxyde de carbone) contenant des liaisons fortes, et ce processus dégage une grande énergie. Cela est illustré dans la figure par la différence de taille entre le point de départ à gauche à la fin de la réaction à droite. À mesure que la différence en termes d'énergie libre entre les réactifs et les produits augmente, l'énergie libérable lorsque la réaction intervient augmente également.
Toutefois, pour passer des réactifs aux produits, les molécules doivent posséder suffisamment d'énergie pour déclencher la réaction. Les réactions commencent souvent par une rupture des liaisons. Or, les liaisons fortes nécessitent beaucoup d'énergie pour se rompre. Par conséquent, pour que la réaction d'une molécule stable se déclenche, il faut une grande quantité d'énergie. Cette énergie est appelée barrière d'activation et elle est illustrée par la hauteur de la courbe au milieu du parcours de la réaction.
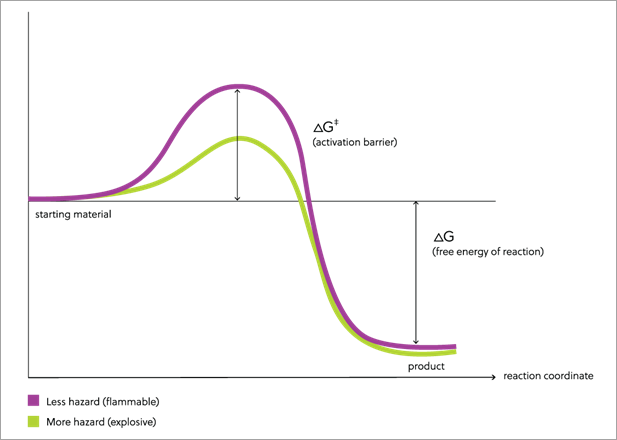
Une fois la barrière surmontée, la réaction peut se produire. Comme la différence d'énergie libre entre les réactifs et les produits est importante, la réaction d'une molécule peut produire une énergie suffisante pour permettre aux autres molécules de surmonter la barrière d'activation. La réaction peut alors s'accélérer et être difficile à arrêter tant que les réactifs ne sont pas consumés. Une fois qu'un incendie se déclenche avec de l'essence, il peut être difficile à éteindre. En outre, comme les produits sont gazeux (dioxyde de carbone et vapeur), ils occupent beaucoup plus de place que les réactifs. L'expansion du volume transfère de l'énergie à l'environnement ; si la réaction se produit dans un espace clos, une explosion peut survenir. Comme il faut plus d'énergie pour provoquer la combustion de l'essence, il est plus facile d'éviter les actions qui produisent cette énergie et, donc, de prévenir les incendies.
Examinez des exemples de produits chimiques explosifs ici, et pour plus d'informations sur la sécurité des produits chimiques ou les substances, consultez la Bibliothèque de la sécurité chimique et CAS Chimie commune.
D'autres substances présentent des risques plus importants. Bon nombre d'entre elles contiennent des liaisons chimiques faibles. La figure 1 (ligne verte) présente également un modèle de réaction comme la combustion d'une molécule contenant une liaison faible. Comme dans le cas de l'essence, la différence d'énergie libre (illustrée par la différence de hauteur) entre les réactifs à gauche et les produits à droite est importante ; les produits contiennent des liaisons fortes, et la réaction libère une grande quantité d'énergie lorsqu'elle se produit. La hauteur de la barrière à cette réaction, toutefois, est nettement moindre que celle de la combustion de l'essence.
Les réactions commencent souvent par la rupture d'une liaison, et la présence d'une liaison faible offre un endroit propice au début d'une réaction. Une fois la liaison rompue, la réaction peut se poursuivre jusqu'à son terme. Lorsque les produits sont beaucoup plus faibles en énergie que les réactifs, comme c'est le cas ici, la réaction d'une seule molécule peut libérer une énergie qui cause une réaction des autres molécules ; comme la barrière à la réaction est plus basse, un plus grand nombre de molécules peuvent être incitées à réagir à partir de la réaction d'une molécule de la substance dans la figure 1 (vert) qu'à partir de la réaction d'une molécule de la substance dans la figure 1 (violet). La présence d'une liaison faible signifie que la réaction, une fois lancée, peut s'accélérer rapidement. Si les produits sont des gaz, ils transféreront aussi du travail à leur environnement ; si la réaction est assez rapide, une explosion ou une détonation peut se produire. La barrière plus basse à la réaction d'une substance contenant une liaison faible signifie qu'il faut moins d'énergie pour déclencher sa réaction, de sorte que les manières de la manipuler sont plus limitées. Dans certains cas, un impact, une friction ou des étincelles résultant de la manipulation peuvent initier une réaction, de sorte que la manipulation de telles substances nécessite beaucoup plus de précaution pour éviter un incendie ou une explosion.
Les azides (RN3) illustrent parfaitement ce point. Ces substances contiennent trois atomes d'azote connectés avec des liaisons de force inégale. Les atomes d'azote peuvent former des liaisons fortes : la triple liaison entre les atomes d'azote dans l'azote gazeux moléculaire (N2) est l'une des liaisons chimiques les plus fortes connues ; toutefois, les atomes d'azote peuvent aussi former des liaisons simples et doubles, qui sont nettement plus faibles. L'une des liaisons azote-azote de l'azide est faible et sa rupture ne nécessite pas beaucoup d'énergie, ce qui entraîne une décomposition rapide qui produit du N₂. Comme la liaison azote-azote du N2 est beaucoup plus stable que les liaisons azote-azote de l'azide réactif, cette décomposition libère une grande quantité d'énergie.
Les azides inorganiques et organiques présentent des sensibilités variables. L'azide de sodium inorganique peut être manipulé de manière plus sûre dans des conditions normales, mais se déploie comme un générateur de gaz rapide dans les airbags qui équipent les véhicules, tandis que les azides de métaux lourds hautement volatils, tels que l'azoture de plomb, sont utilisés comme initiateurs pour les explosifs. Les azides organiques sont couramment utilisés dans la synthèse de produits chimiques plus complexes, y compris des produits pharmaceutiques et des polymères. Les azides organiques à faible poids moléculaire ou qui présentent un ratio atomique azote (N) à carbone (C) élevé peuvent être explosifs, et plusieurs incidents d'explosions en laboratoire ont été rapportés en raison de la formation d'azides à faible poids moléculaire suite aux réactions entre azides inorganiques et dichlorométhane. Un acide aminé modifié par un azide utilisé pour préparer des protéines modifiées s'est également avéré explosif.
Les peroxydes (ROOR) sont une autre catégorie de molécules présentant des caractéristiques potentiellement explosives. Les peroxydes contiennent des liaisons oxygène-oxygène faibles ; lorsque ces liaisons se rompent, les peroxydes libèrent des intermédiaires radicaux (radicaux libres) qui sont utiles dans les réactions chimiques. Les intermédiaires radicaux sont particulièrement utiles pour initier la polymérisation et sont couramment détectés en tant qu'intermédiaires dans la combustion ; même de petites quantités de radicaux peuvent agir comme des catalyseurs et, dans certains cas, ils catalysent leur propre formation. Les peroxydes se fragmentent également pour libérer de l'oxygène moléculaire (O₂) ; alors que la liaison simple oxygène-oxygène est faible, la double liaison oxygène-oxygène de l'O2 est forte, de sorte que cette fragmentation libère de l'énergie.
La liaison oxygène-oxygène faible signifie que les peroxydes peuvent se décomposer facilement, libérant des radicaux libres et de l'O₂, une combinaison volatile et explosive, en particulier lorsqu'elle est concentrée. Plusieurs incendies majeurs ont été signalés dans des installations chimiques utilisant des peroxydes, dont une au Texas, aux États-Unis, lorsque l'ouragan Harvey provoqua des inondations sans précédent qui entraînèrent la défaillance des mécanismes de sécurité. Les peroxydes peuvent aussi se former spontanément suite à l'exposition d'éthers à l'oxygène. Ces peroxydes forment des cristaux qui peuvent exploser lorsqu'ils sont soumis à un choc physique, une friction ou une réaction avec certains métaux. Les éthers sont normalement formulés avec de petites quantités d'inhibiteurs comme le BHT (hydroxytoluène butylé, utilisé comme conservateur) pour empêcher la formation de peroxydes. Les inhibiteurs sont consumés par l'oxygène ; si les éthers sont conservés trop longtemps en présence d'oxygène, ils sont susceptibles de former des peroxydes.
Un besoin urgent de stabilité
D'autres substances possèdent des liaisons qui, même si elles ne se rompent pas facilement seules, peuvent facilement réagir dans certaines conditions pour former des produits beaucoup plus stables. Alors que de nouvelles liaisons se forment, une énergie est libérée et peut provoquer de la chaleur, des incendies ou des explosions. Par exemples, les alkyles métalliques sont utilisés comme catalyseurs dans la synthèse d'un grand nombre de produits chimiques et de matériaux, mais ils sont souvent pyrophores, brûlant facilement au contact de l'air.
Le triméthylaluminum, en particulier, réagit à l'air ou à l'eau en libérant des produits à liaison aluminium-oxygène extrêmement stable, ce qui aboutit à des incendies ou à des explosions.
Les acrylates sont utilisés dans la polymérisation à échelle industrielle ; chaque monomère d'acrylate remplace sa double liaison par une liaison simple supplémentaire au moment de son intégration à la chaîne de polymères. Cette nouvelle liaison est plus forte que la force cumulée de la double liaison, de sorte que la réaction de polymérisation libère de l'énergie. La polymérisation des acrylates et d'autres alcènes se déroule souvent en utilisant des initiateurs de radicaux comme les peroxydes pour lancer les réactions de polymérisation, en utilisant la même réactivité qui, en d'autres circonstances, aboutit à leur explosion. Dans les chambres de polymérisation à grande échelle, lorsque le ratio entre surface et volume est trop faible pour dissiper la chaleur formée et que des inhibiteurs de polymérisation incontrôlée sont consumés, inactivés ou éliminés, les acrylates peuvent se polymériser de manière explosive.
De même, des solvants comme le diméthylsulfoxide (DMSO) peuvent réagir à un certain nombre de substances, comme les acides, les bases et les électrophiles, pour réduire les températures de décomposition ; les réactions, même à des températures plus basses et apparemment plus sûres, peuvent malgré tout provoquer une explosion.
Exploiter le plus grand catalyseur du monde moderne
En son centre, la chimie est rendue possible par les changements d'énergie, et, depuis des siècles, les humains valorisent et exploitent cette énergie pour parcourir le monde, faire fonctionner l'industrie et même produire les aliments qui se trouvent sur notre table, les vêtements que nous portons et la trame de nos villes. Nous convoitons les produits chimiques explosifs et volatils pour leur énergie et, pourtant, leur puissance peut avoir des conséquences inattendues et dévastatrices. En comprenant comment canaliser cette énergie de manière constructive et mieux identifier les conditions lorsque des produits chimiques peuvent réagir de manière inattendue et néfaste, nous sommes en mesure d'anticiper les incidents explosifs avant qu'ils ne se produisent et apprendre à les prévenir.
Pour plus d'informations sur le nitrate d'ammonium, ses dangers et les règles de sécurité, téléchargez notre rapport CAS Insights complet et regardez notre webinaire qui réunit des experts majeurs évoquant les options de formulation et le paysage de l'innovation.


