夏季オリンピックは、勝利、決意、そしてアスリートの偉業の驚くべき物語を紡ぎます。 アスリートは常にルールの範囲内で優位性を見つけようとするものですが(ダイエット、高圧室、凍結療法など)、運動能力向上剤(PED)は越えてはならない一線です。 運動能力向上剤は、国際オリンピック委員会、米国ドーピング防止機構と世界ドーピング防止機構により絶えず調査、追跡、検査されています。 薬物も方法論も進化していても、オリンピックからツール・ド・フランス、アイアンマントライアスロン、さらにはクロスフィットゲームなどのニッチなスポーツまで、いまだに主要な運動能力向上剤はアナボリック・アンドロゲンステロイド(AAS)です。 本ブログ記事では、一般的な運動能力向上剤の詳細と、それらを検出するための対策を紹介します。
運動能力向上剤とは
ステロイドとその代謝物、そしてテストステロンの構造的な理解は、その検出用の分析プロトコルを開発する上で重要です。 テストステロン(T)は、天然に産生されるホルモンで、アンドロゲン受容体のネイティブリガンドです。 この受容体がテストステロンや合成ステロイドなどのアンドロゲンと結合すると活性化され、筋力、骨密度、赤血球の生産量の増加など、望ましい運動能力向上効果が得られます。 アスリートにとって筋肉や骨が強くなるのは当然の強みですが、赤血球の生産量が増えることでも筋肉や臓器に多くの酸素が供給され、エネルギーの生産と回復を促進します。 従ってテストステロンは(合成および天然のいずれも)、アナボリックステロイドの基礎になっています。
アナボリックステロイドは、主に3つのカテゴリーに分類されます(下図1)。
- テストステロン誘導体
- 5α-ジヒドロテストステロン(DHT)誘導体
- 19-ノルテストステロン誘導体
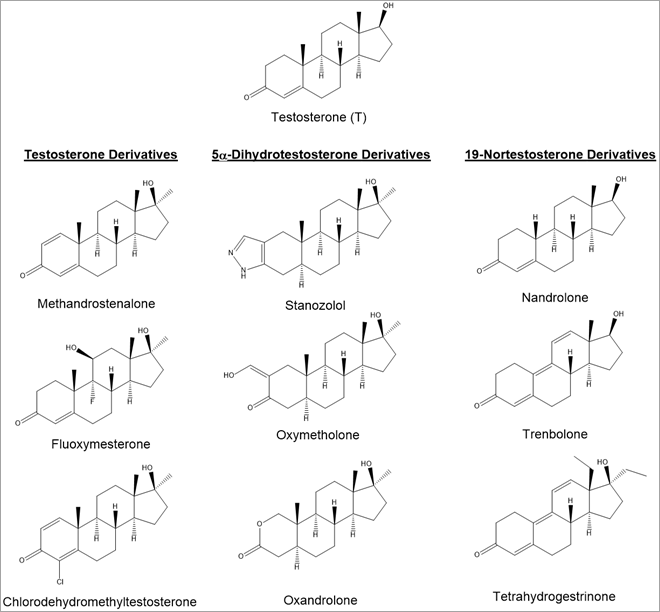
図1:一般的なアナボリック・アンドロゲン作用のあるテストステロン誘導体、5α-ジヒドロキシテストステロン誘導体、19-ノルテストステロン誘導体と比較した、テストステロンの構造。
構造、基質活性、半減期の違いは、これらのアナボリック・アンドロゲン作用のあるテストステロン誘導体の生物学的特性に影響を与えます。 特に誰もが自然にテストステロンを持っているため、こういったところでの違いこそが化合物を検出する方法を設計する上での基礎になります。
運動能力向上剤の検出方法
それぞれの薬物について、その主要な代謝物を特定することが、尿や血液、または唾液による直接的な診断検査を開発する第一歩になります。 ヒトの体内では、天然の(内因性の)テストステロン(T)とエピテ ストロン(E)は約 0.4-2 の割合で生成されています(図 2A)1。 初期の検出方法では、尿検体中のテストステロンとエピテストステロンの比率を単純に測定するものなどでした。 T/Eレシオが4を超えていると、外因性テストステロン製剤によるドーピングが疑われました。 ラボで作られたTは内因性T2よりも13C:12Cの比がわずかに低いので、外因性Tの存在を確認するためには、ラボではTの13C:12Cの同位体比を測定します。 この方法は、2006年のツール・ド・フランスでのフロイド・ランディス氏の起訴において、彼が実際に外因性テストステロンを使用していたことを証明するのに使用されました。
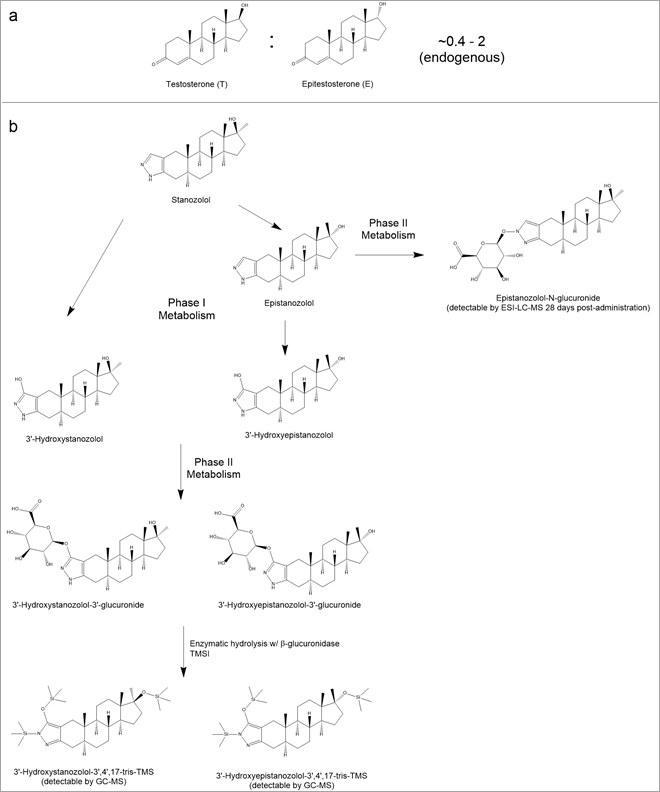
図2. アナボリック・アンドロゲンステロイド検出のためのテスト用パラメータ。 A:テストステロン(T)とエピテストステロン(E)の構造。人体では0.4〜2の割合で生成される。 T/E値が4以上の場合は、AASドーピングの証拠とみなされる。 B:尿検査によるスタノゾロール検出に必要な代謝物と分析方法。
何か新しいステロイド系薬物が初めて運動競技に登場すると、その検出と分析のためには薬物の特性と代謝を理解することが規制当局に課せられた責務になります。 1988年のソウルオリンピックで、短距離走者のベン・ジョンソンが100m走で世界記録を出した後、スタノゾロールの陽性反応が出て金メダルを剥奪された件が、これにあたります。 この薬物の検出方法を開発するために、研究者はスタノゾロールの代謝を理解し、どうすれば最も高感度で検出できるかを把握する必要がありました。 スタノゾロールの主な代謝経路は図2Bの縦の経路で示されます。なお、従来からあるガスクロマトグラフ質量分析計(GC-MS)3による代謝物の検出に必要なサンプル処理もそこに示されています。 ただしスタノゾロールは、図2Bの水平経路に示す17-エピ・スタノゾロール-N-グルクロニドという別の代謝物も少量産生します。 この代謝物は長期間存続し、なんと投与後28日目でも検出できます。 この代謝物からスタノゾロールを検出するために、エレクトロスプレーイオン化法(ESI)と液体クロマトグラフィー質量分析法(LC-MS)を組み合わせた複合的な方法が最近開発されました。 簡単に言うと、こういった手法ではイオンが生成され、それは質量によって分離・同定できるため、そこに存在する代謝物の特性を明らかにし、そして同定することができるようになるわけです。
なぜ運動能力向上剤は継続的な問題なのか
2000年代初頭、科学者たちがアナボリック・アンドロゲン作用のあるステロイドを検出する技術の改良に忙殺されている間、バリー・ボンズはホームランを量産していました。 実際はその舞台の裏側では、ボンズをはじめ他の選手たちが新しい合成ステロイド、テトラヒドロゲストリノン(THG)が使用していたことを、MLBはまったく知りませんでした。これは、ドーピング防止検査規定を念頭に置いて特別に設計された、強力なアナボリック作用を持つステロイドだったのです。 これは「The Clear」と呼ばれるTHGというもので、ドーピング防止プログラムは当初その存在と代謝物を知らなかったため、尿から検出できませんでした。 ところが調査の際に、使用済み注射器の残渣からTHGを抽出してその同定に成功しました。その後はスクリーニング用のLC-MS/MS法を容易に開発できたのです4。
この野球界のスキャンダルは、ドーピング防止プログラムにおけるAASの直接検出をめぐる問題の代表例です。 第一に、スクリーニングのプロセスでは、既知の物質の既知の代謝物を探します。従って設備の整った組織なら、検出を逃れるためには、まだ見たことがない「デザイナーステロイド」を合成すればうまくいくわけです。 さらに、検査手順が定められたとしていても、検査頻度が少ないと(年に2回検査を実施するMLBなど)、ステロイドの使用が検出されないことがあります。検査間隔が長いと、その間にステロイド代謝物の濃度が検出限界以下になるためです。 また、発見されないようにアスリートが隠ぺい剤や利尿剤を使用することも可能です5。こうなると検査実施側はさらなる負担を強いられることになります。
ドーピング防止機構はこうした問題を認識していましたが、封じ込めに向けた取り組みをしていたにもかかわらず、運動能力向上剤は使用され続けてきました。 外因性物質がなければ、尿中のテストステロン、その前駆体およびその代謝物の濃度と比率は意外と安定していること、そしてアナボリック・アンドロゲンステロイドがこの安定した値に持続的に影響を与えることが、1990年代にはすでに研究で示されていました。 しかし、2007年になるまでは、この比率の異常値を検出するためにベイズ推定を正式に採用されませんでした。 これらの比率は、血液学的プロファイルとともに、アスリート生体パスポート(ABP)を構成します。 このパスポートは、運動能力向上剤の検出能力を高める上での強力なベンチマークツールです。
運動能力向上剤監視の今後の展開
In vitroバイオアッセイは、アンドロゲン検出のもうひとつの有望な非標的アプローチです。 アンドロゲン応答配列の制御下にあるレポータータンパク質で細胞を変化させることにより、これらのアッセイは、そのソースに関係なくアンドロゲン受容体の活性化を検出することができます6。 そのため、近年スポーツ選手が誤って禁止薬物を摂取する原因となっているサプリメントなど、組成が不明な試料中のアンドロゲンを検出する目的でもバイオアッセイは有用です。 今後、それがステロイド性であっても、あるいはテストステロンと構造的に類似しておらず、そのためその代謝が把握されていない選択的アンドロゲン受容体モジュレータの新しいクラスの一部であっても、さらなる非標的生物活性に基づく検出方法の開発によって、新しいアンドロゲンを特徴付ける上で研究者の助けとなるでしょう7(図3)。
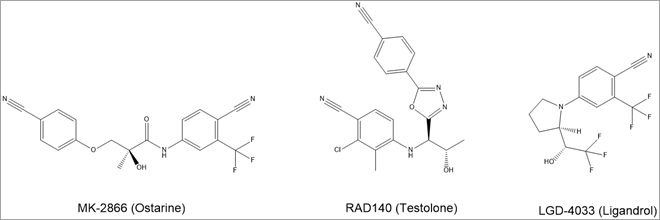
図3 不正使用される一般的な選択的アンドロゲン受容体モジュレータ(SARM)の化学構造。
まとめ
オリンピックを迎えるにあたり、そしてそれ以降も、個人による、そして時には所属組織の意向に沿った形でのドーピングのスキャンダルが起こることは間違いありません。 これもエリート選手が参加するスポーツの特徴のひとつになってしまっています。 デザイナードラッグは、その性質上、臨床的な安全性試験が行われていないため、アスリートの健康を損なう恐れがあります。 しかし、スポーツ団体が薬理学を駆使して創意工夫を続けているように、科学はドーピング防止機構に運動能力向上剤の検出に必要な知識と分析能力を提供し続けるでしょう。 こうした分析能力を最大限に高めることが、ドーピングを最小限に抑え、スポーツ界における健康を促進し、公正さを保つ抑止力になるのです。
参考文献
1. Donike, M., Nachweis von exogenem Testosteron. Dt. Ärzte-Verl.: Köln, 1983; p S. 293-298.
2. Polet, M.; Van Eenoo, P., GC-C-IRMS in routine doping control practice: 3 years of drug testing data, quality control and evolution of the method. Anal Bioanal Chem 2015, 407 (15), 4397-409.
3. Schänzer, W.; Opfermann, G.; Donike, M., Metabolism of stanozolol: identification and synthesis of urinary metabolites. J Steroid Biochem 1990, 36 (1-2), 153-74.
4. Catlin, D. H.; Sekera, M. H.; Ahrens, B. D.; Starcevic, B.; Chang, Y. C.; Hatton, C. K., Tetrahydrogestrinone: discovery, synthesis, and detection in urine. Rapid Commun Mass Spectrom 2004, 18 (12), 1245-049.
5. Alquraini, H.; Auchus, R. J., Strategies that athletes use to avoid detection of androgenic-anabolic steroid doping and sanctions. Molecular and Cellular Endocrinology 2018, 464, 28-33.
6. Lund, R. A.; Cooper, E. R.; Wang, H.; Ashley, Z.; Cawley, A. T.; Heather, A. K., Nontargeted detection of designer androgens: Underestimated role of in vitro bioassays. Drug Testing and Analysis 2021, 13 (5), 894-902.
7.Thevis, M.; Schänzer, W., Detection of SARMs in doping control analysis. Molecular and Cellular Endocrinology 2018, 464, 34-45.