En la carrera para desarrollar tratamientos contra la COVID-19, es esencial que los científicos tengan una visión clara del mecanismo exacto empleado por el virus para entrar en nuestras células. Esta información permitirá el desarrollo de tratamientos antivirales diseñados para bloquear esa ruta.
Las investigaciones disponibles sobre el primer virus SARS-CoV, que apareció en 2002 y causó una epidemia, y sobre el SARS-CoV-2, el coronavirus que ha provocado la pandemia de COVID-19, demuestran que en los dos casos una proteína de la espícula (S) que sobresale de la membrana del virus se une al menos a una proteína, la enzima convertidora de angiotensina 2 (ECA2), de la superficie de las células humanas. Después de unirse, las proteasas, que son enzimas humanas que fragmentan otras proteínas, cortan o “preparan” la proteína de la espícula para eliminar su segmento exterior, conocido como S1, y dejar expuesto el segmento interior, S2. A continuación, el segmento S2 de la proteína de la espícula provoca la fusión de la membrana del virus con las membranas de la célula humana y permite que el material genético del virus entre en la célula y empiece a replicarse. En una entrada reciente del blog se resumió este proceso destacando el papel de ACE2. En esta entrada, profundizaré en el papel de las proteasas humanas, que ayudan al virus a entrar en nuestras células, y repasaré los tratamientos antivirales basados en esa interacción.
La proteína de la espícula del SARS-CoV-2: historia de dos segmentos
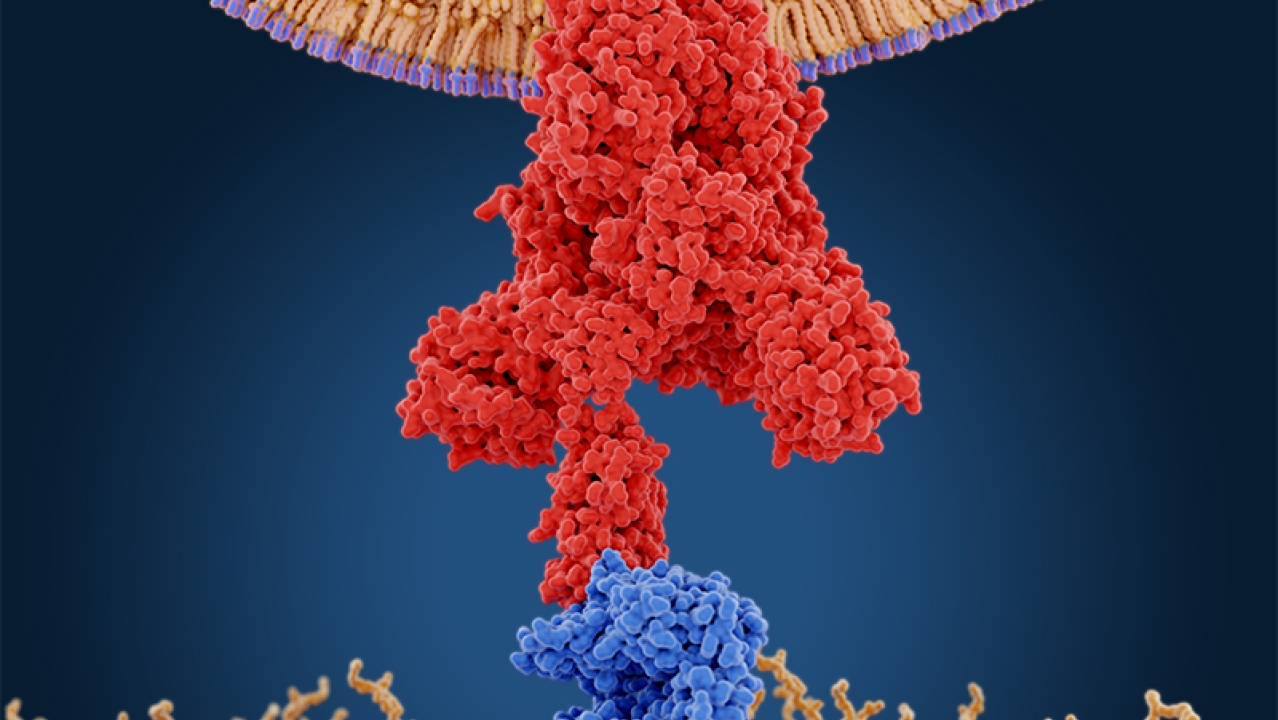
La proteína de la espícula del SARS-CoV-2 tiene una forma similar a un tornillo con una cabeza grande y un tallo largo y delgado (figura 1). Tres proteínas de la espícula se unen entre sí para crear un trímero, que, como es previsible, tiene la forma de un tornillo más grande. El tallo está insertado en la membrana del virus y sujeta la cabeza, que sobresale del virus. La región de la cabeza, de mayor tamaño, y parte del tallo se conocen como región S1 de la proteína de la espícula. El resto del tallo, más cercano a la membrana del virus, se denomina región S2.
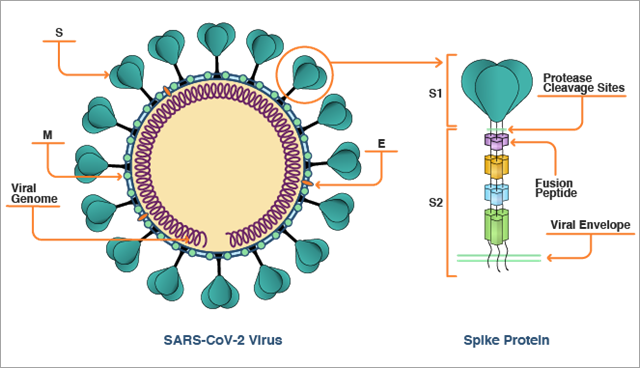
Una vez que penetra en el cuerpo y entra en contacto con el aparato respiratorio, el tubo gastrointestinal, los vasos sanguíneos u otras células que expresen ECA2 en sus superficies, la región S1 de la proteína de la espícula se une a ECA2 en la superficie celular y ancla el virus en el exterior de la célula humana. Este es el primer paso del proceso de replicación del virus.
El SARS-CoV-2 entra en las células de dos formas
Una vez que el virus se ha unido a la célula, tiene dos posibles vías de acceso (figura 2). La vía utilizada dependerá de si hay proteasas humanas presentes para “preparar” la proteína de la espícula. La presencia de proteasas depende del tipo de célula humana en la que intenta entrar el virus y de las condiciones concretas existentes en esa célula. Varias proteasas humanas pueden escindir la proteína de la espícula, entre ellas la proteasa transmembrana de serina 2 (TMPRSS2), la furina, la elastasa y la tripsina. La TMPRSS2 se expresa en las células pulmonares humanas. Por este motivo, se cree que desempeña un papel importante en la entrada del virus en las células del aparato respiratorio.
Si estas proteasas están presentes cerca de la interfaz de unión de la espícula con ECA2, escinden la proteína de la espícula para exponer la región S2 y, en concreto, la región del péptido de fusión de la proteína de la espícula. La región del péptido de fusión de la proteína de la espícula está integrada por aminoácidos más hidrofóbicos o similares a lípidos y se inserta en la membrana celular, que contiene lípidos, para inducir la fusión entre la membrana del virus y la membrana celular y la posterior entrada del genoma del virus en la célula (figura 2a). Esta escisión se debe producir después de la unión entre la espícula y ECA2. Si se da antes, el virus tiene menos capacidad para infectar la célula.
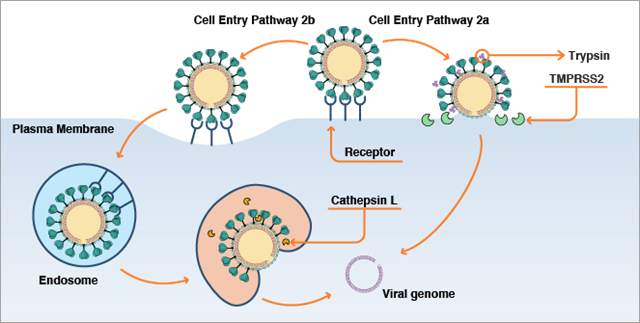
Si no hay proteasas cerca de la interfaz de unión entre la espícula y ECA2, el virus entra en la célula por otra vía denominada endocitosis (figura 2b). En este proceso, los coronavirus unidos a las proteínas ECA2 del exterior de la célula son envueltos por un entrante de una región pequeña de la membrana celular que, a continuación, se desprende formando una vesícula pinocítica que lleva el material externo al interior de la célula. Después, la vesícula pinocítica se fusiona con una vesícula intracelular rodeada de membrana que se conoce como endosoma. En el endosoma existen proteasas, incluida una denominada catepsina L, que pueden escindir la proteína de la espícula y dejar expuesta la región del péptido de fusión. Este péptido favorece la fusión de la membrana del virus con la membrana del endosoma y permite la entrada del genoma vírico en la célula.
Algunos datos recientes sugieren que puede haber una tercera vía de entrada del SARS-CoV-2 en las células. Cuando el virus se está replicando y creando nuevas partículas víricas dentro de las células, algunas de las proteínas de la espícula pueden haber sido preescindidas o preparadas por una proteasa humana llamada furina durante el proceso de ensamblaje del nuevo virus. Esto significa que, una vez que el virus sale de la célula, los que tienen proteínas de la espícula ya escindidas se pueden fusionar con otras células e infectarlas aunque estas tengan niveles de proteasas demasiado bajos para las dos vías de escisión de la proteína de la espícula “normales” que se han descrito antes.
Planificación del contraataque
Los investigadores están trabajando sin descanso para encontrar fármacos que actúen sobre los pasos de unión de la espícula y ECA2, fusión de las membranas y endocitosis del ciclo de infección para luchar contra la COVID-19. En nuestra entrada anterior hablamos del potencial terapéutico del ECA2 soluble recombinante. Actúa inactivando la proteína de la espícula antes de que el SARS-CoV-2 pueda unirse a ECA2 en la superficie de las células. Pero se están evaluando otros muchos posibles fármacos.
Nafomastat y MI-1851 inhiben las proteasas implicadas en la escisión de la proteína de la espícula (TMPRSS2 y furina, respectivamente) y han demostrado potencial para reducir la infección del SARS-CoV-2 en el tubo de ensayo. También se ha visto que los péptidos, que son proteínas muy cortas similares a pequeñas regiones de la proteína de la espícula, inhiben la fusión de las membranas del virus y la célula humana “taponando” la proteína de la espícula preparada en el virus mientras cambia de forma durante el proceso de fusión de las membranas. Esto impide la entrada del virus. Por último, los inhibidores PIKfyve son bloqueadores conocidos de la infección del SARS-CoV-2. PIKfyve es una cinasa lipídica humana, una enzima que añade un grupo fosfato a algunos lípidos. Como PIKfyve participa en el metabolismo endosómico en la vía endocítica de entrada del virus, los inhibidores de PIKfyve tienen actividad antiviral.
Estos son solo algunos de los muchos fármacos que se están estudiando como inhibidores de la entrada del SARS-CoV-2. Sin embargo, hay muchas posibles dianas para los investigadores que están buscando tratamientos para la COVID-19. La proteína de la espícula, ECA2, las proteasas que escinden la proteína de la espícula y los componentes de la vía endocítica ya se están estudiando, y hay muchas sustancias que tienen actividad antiviral sobre cada una de estas dianas. Para ayudar a los científicos a identificar algunos de los posibles candidatos en menos tiempo, CAS ha creado un conjunto de datos de código abierto recopilado en CAS REGISTRY® que incluye medicamentos antivirales conocidos y compuestos químicos relacionados que son estructuralmente similares a antivirales conocidos. Puede obtener más información sobre él y descargar este conjunto de datos y otros recursos de acceso abierto de CAS para la COVID-19 aquí.