Gain new perspectives for faster progress directly to your inbox.

Como clase terapéutica, los inhibidores covalentes han ganado popularidad en los últimos años, y la Food and Drug Administration (FDA) de Estados Unidos ha aprobado diversos fármacos covalentes para varias indicaciones, centradas principalmente en el tratamiento del cáncer. Su mecanismo de acción único ofrece algunas ventajas con respecto a otros inhibidores no covalentes más comunes, lo que los convierte en una alternativa prometedora para el desarrollo terapéutico.
Tradicionalmente, los investigadores evitaban estudiar los inhibidores covalentes porque planteaban problemas relacionados con la seguridad, el diseño y la fabricación, pero esta tendencia está cambiando.
CAS ha identificado más de 10 000 artículos científicos relacionados con un subconjunto de inhibidores covalentes desde el año 2000. Las iniciativas de investigación se han intensificado en la última década y las publicaciones en revistas se han cuadruplicado desde 2010 (figura 1).
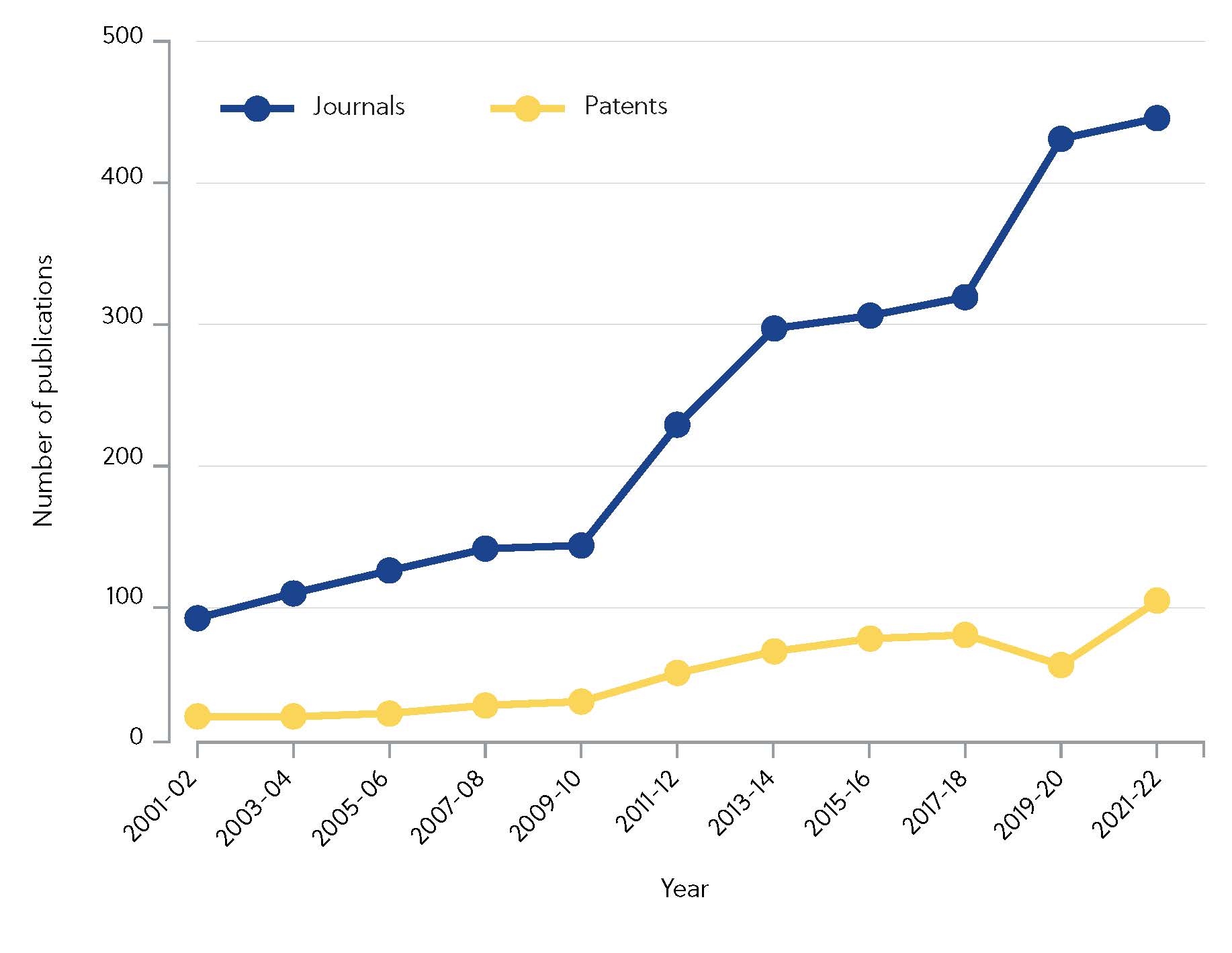
La inversión está dando frutos y algunos medicamentos superventas como ibrutinib y osimertinib generaron ventas por un total de 4330 millones de dólares en 2020. La pregunta es: ¿qué son exactamente los inhibidores covalentes y por qué están empezando a ganar terreno con respecto a otros inhibidores no covalentes en los planes de diversos laboratorios académicos y empresas?
Como sugiere su nombre, los inhibidores covalentes forman un enlace covalente con las proteínas diana y, al hacerlo, suelen modificarlas de manera irreversible. A diferencia de los inhibidores no covalentes, que se unen de forma reversible, los inhibidores covalentes crean una conexión duradera con su diana, lo que aumenta su potencia y prolonga su actuación. Esto puede tener ventajas y desventajas.
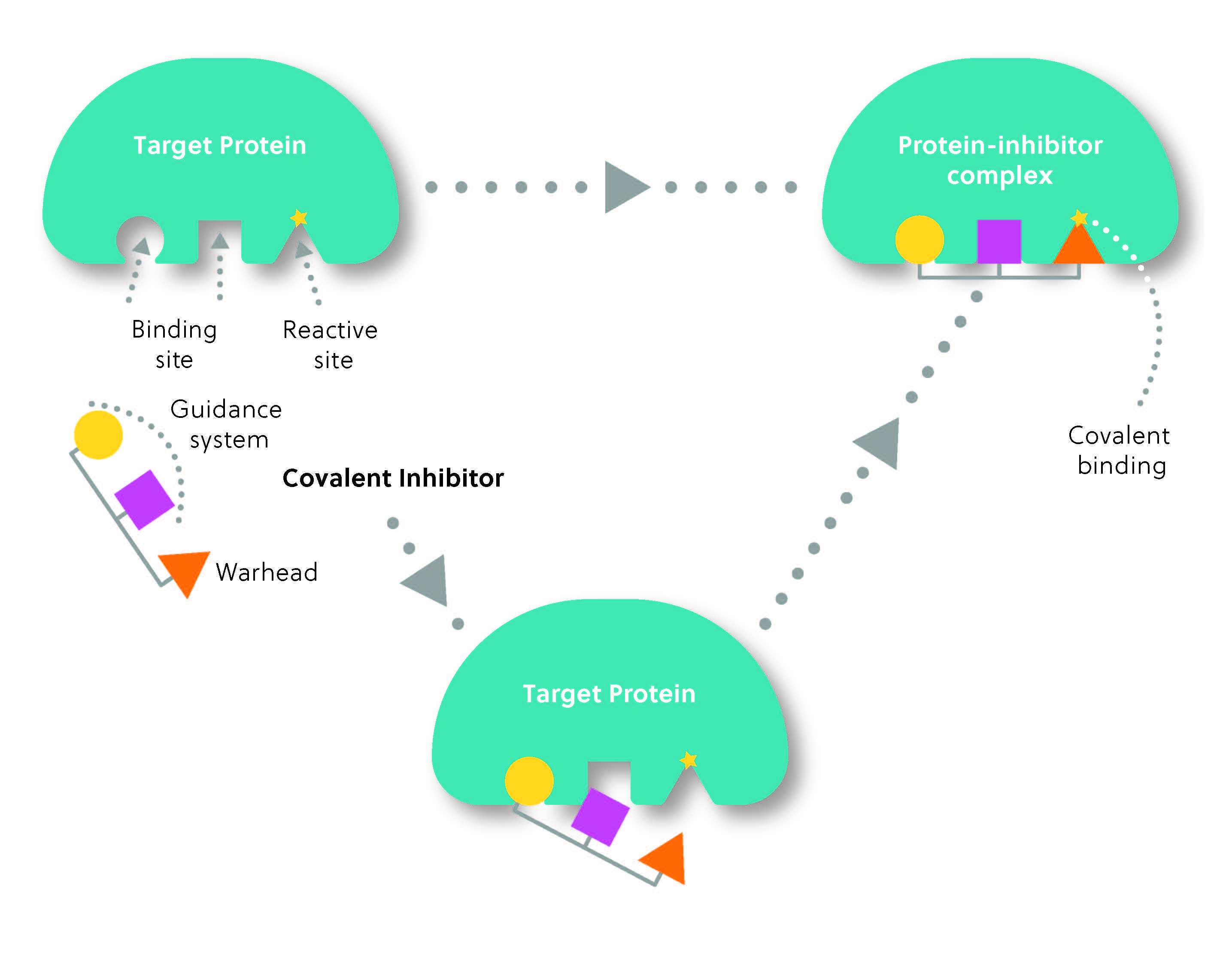
Normalmente, la estructura de un inhibidor covalente se compone de dos partes: el grupo reactivo o “carga explosiva” o útil, que forma el enlace covalente con la diana y el “sistema de guía”, que determina la selectividad del inhibidor con respecto a su diana (figura 2). Es un mecanismo similar al de un misil configurado para buscar el calor: el sistema de guía localiza la diana, mientras que la carga explosiva “cae” en ella para formar el enlace covalente.
Los inhibidores covalentes no son nuevos. De hecho, se usan para tratar enfermedades desde hace más de un siglo. Uno de los ejemplos más tempranos es la penicilina. Los antibióticos de penicilina se unen mediante un enlace covalente a la enzima diana e inhiben la síntesis de la pared celular bacteriana, lo que causa la rotura de la membrana celular. Otro ejemplo conocido es la aspirina, que provoca una acetilación irreversible de una enzima esencial implicada en la producción de mediadores inflamatorios. Curiosamente, el descubrimiento de que estos fármacos actúan mediante mecanismos covalentes se realizó cuando su uso ya se había generalizado. De hecho, muchos fármacos de inhibidores covalentes populares se descubrieron fortuitamente y no a través de un proceso racional de diseño.
Ventajas de los inhibidores covalentes
Los inhibidores covalentes ofrecen numerosas ventajas potenciales. Mientras que los inhibidores no covalentes se asocian a las enzimas y se disocian de ellas libremente, los covalentes forman enlaces duraderos y fuertes con sus dianas. Eso significa que pueden interrumpir la actividad de la proteína diana durante un periodo largo, con lo que sus efectos terapéuticos son más duraderos. Esta actividad prolongada implica que los medicamentos se pueden administrar en dosis más bajas y menos frecuentes, lo que puede disminuir el riesgo de efectos adversos, mejorar el seguimiento del tratamiento por parte de los pacientes y reducir los costes del tratamiento.
Además, los inhibidores covalentes son excepcionalmente selectivos y actúan con precisión sobre las dianas previstas. Esta propiedad les permite actuar sobre proteínas esquivas a las que otros inhibidores no covalentes no pueden acceder fácilmente, como las que carecen de bolsillos de unión convencionales. De hecho, dianas tradicionalmente consideradas sin afinidad farmacológica, como KRAS (el oncogén que muta con más frecuencia), ahora se pueden tratar gracias a los inhibidores covalentes. La aprobación del primer inhibidor de KRAS, sotorasib, representó un hito importante en la lucha contra tipos de cáncer difíciles de tratar.
Desventajas de los inhibidores covalentes
Muchas de las propiedades que convierten los inhibidores covalentes en tratamientos prometedores pueden plantear también desafíos en el desarrollo de fármacos. La naturaleza irreversible del enlace hace necesario que la unión sea selectiva. Sin embargo, si la carga útil no es suficientemente selectiva, el fármaco puede unirse a proteínas distintas de la diana y generar resultados no deseados que pueden ser perjudiciales a largo plazo. Además, algunas proteínas diana pueden mutar o experimentar cambios estructurales que impidan que el inhibidor covalente se una correctamente a ellas y las inhiba. Esto podría llevar a desarrollar resistencia y reducir la eficacia del medicamento a largo plazo.
A causa de estos retos, el diseño de inhibidores covalentes requiere un análisis pormenorizado de varios factores, como la reactividad de la carga útil, la especificidad del lugar de unión y la estabilidad del enlace covalente formado. Los grupos reactivos deben seguir el principio “Ricitos de oro”: deben ser lo suficientemente reactivos para formar un enlace con una diana cuando se crea el compuesto, pero no tanto como para formar enlaces con otras dianas proteínicas o grupos funcionales si el enlace se rompe. Lograr el equilibrio adecuado entre estos factores puede ser lento y complicado.
El avance de los tratamientos con inhibidores covalentes
Los avances tecnológicos han desempeñado un papel crucial en la aceleración del desarrollo de los inhibidores covalentes. Se produjo un punto de inflexión en este campo cuando los investigadores empezaron a centrarse en la covalencia desde el inicio del desarrollo en lugar de descubrir el mecanismo de manera fortuita.
Los investigadores han utilizado dos estrategias fundamentales para crear tratamientos covalentes eficaces: los centrados en ligandos y los centrados en grupos electrófilos. Las estrategias centradas en ligandos consisten en diseñar moléculas pequeñas que puedan reaccionar con residuos de aminoácidos concretos en la proteína diana. Las estrategias centradas en electrófilos se centran en la carga útil del fármaco e identifican los grupos electrófilos reactivos que pueden formar enlaces covalentes con residuos nucleófilos de la proteína diana.
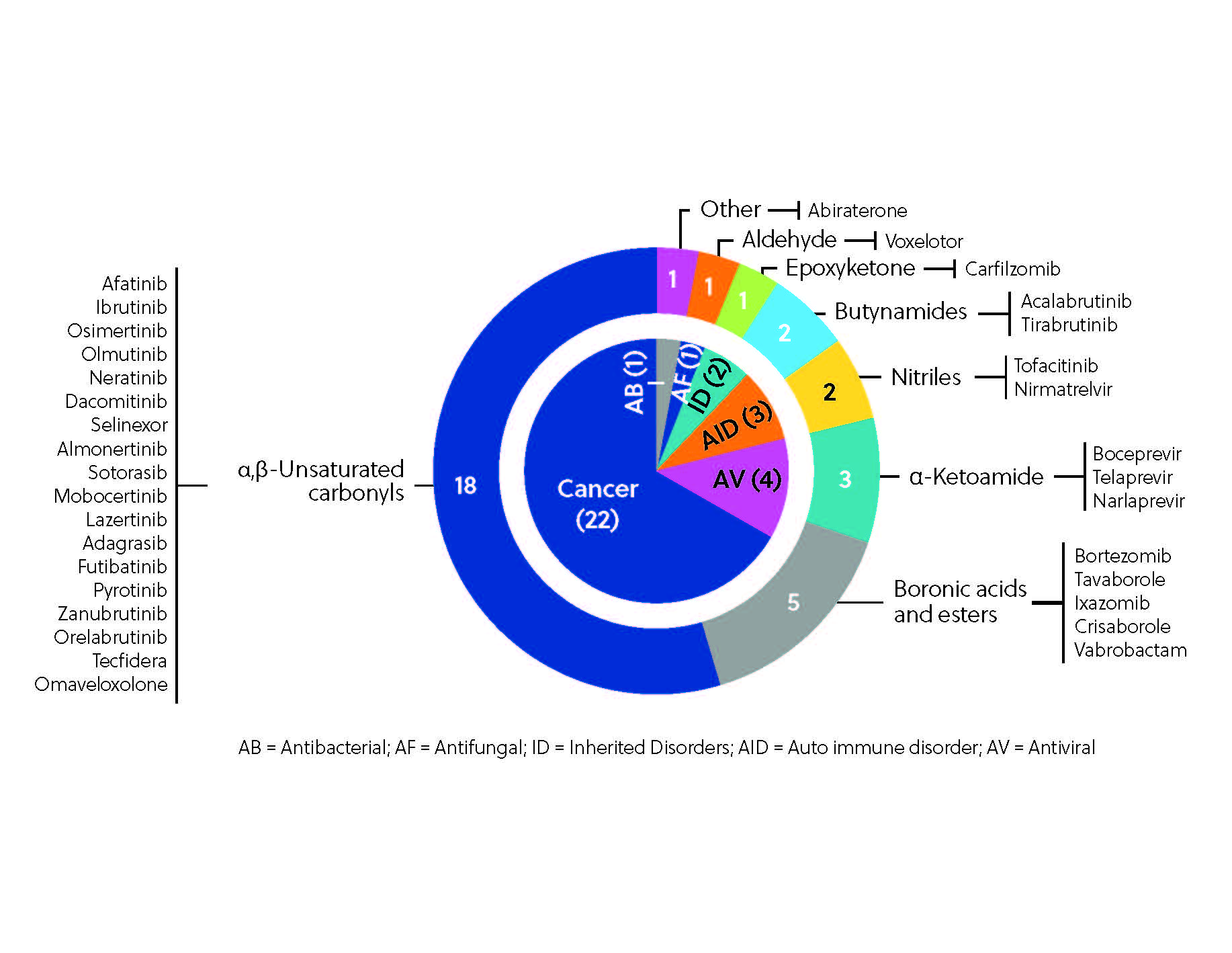
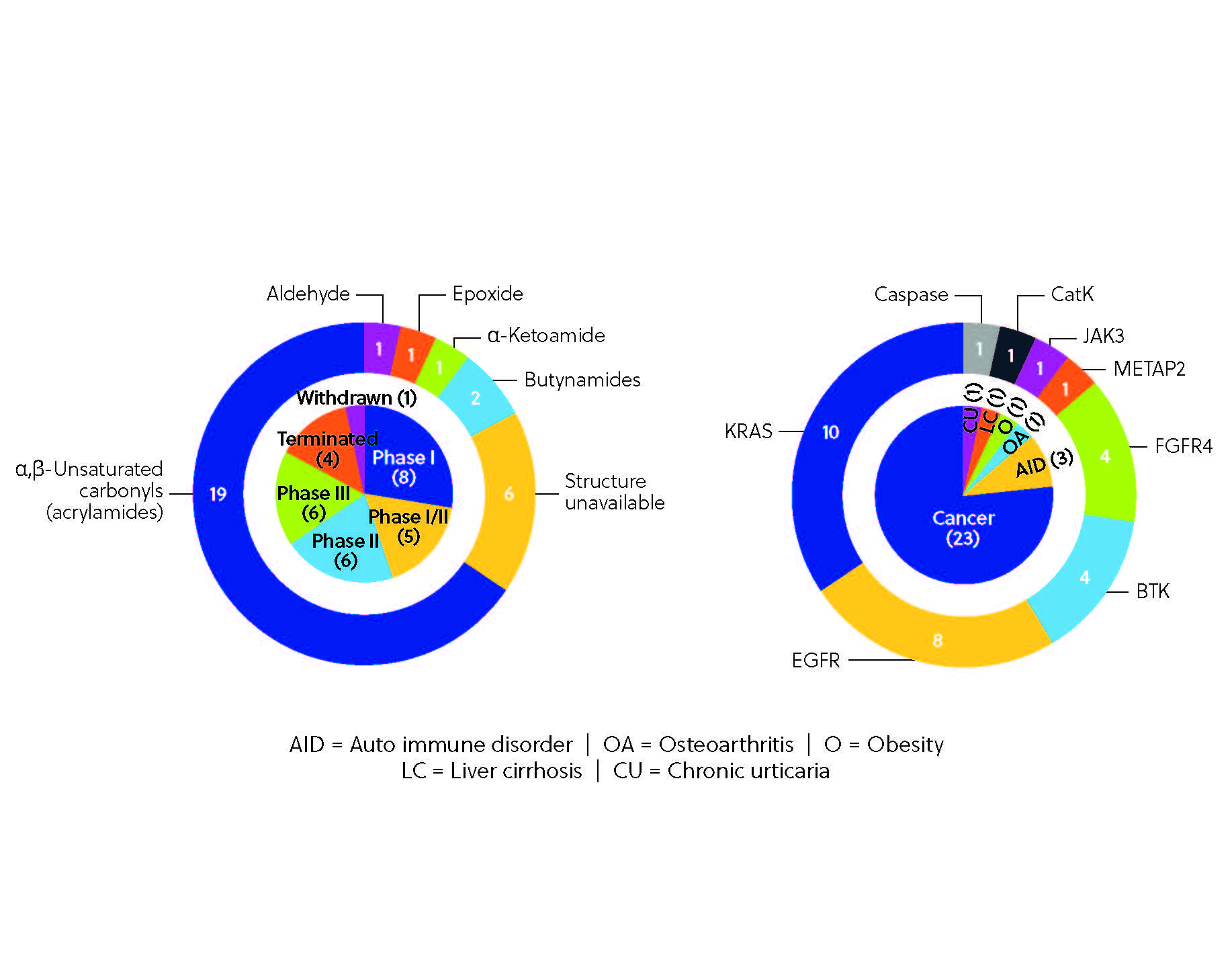
Hasta la fecha, más de 30 inhibidores covalentes han sido aprobados como tratamientos en todo el mundo (figura 3). El más destacado es ibrutinib, que estuvo entre los 10 fármacos más vendidos del mundo en 2021. Ibrutinib es uno de los inhibidores de cinasa más populares descubiertos mediante estrategias centradas en los ligandos, al igual que afatinib, dacomitinib y neratinib.
Otra aplicación prometedora de los enlaces covalentes es su capacidad de inhibir las proteasas víricas. Nirmatrelvir (en combinación con ritonavir), un inhibidor covalente reversible de la proteína MPRO de SARS-CoV-2, ha recibido la aprobación de la FDA como tratamiento para la COVID-19, lo que ha proporcionado una opción de tratamiento oral muy necesaria para los pacientes vulnerables. Nirmatrelvir se desarrolló con una estrategia centrada en los grupos electrófilos mediante una adaptación estructural guiada de un inhibidor covalente que ya se había estudiado con anterioridad.
Una mirada al futuro de los inhibidores covalentes
El proceso de desarrollo clínico de los inhibidores covalentes tiene un enorme potencial. Actualmente se están estudiando varios inhibidores covalentes en ensayos clínicos (figura 4), incluido el inhibidor de BTK remibrutinib; nazartinib, un inhibidor EGFR-TKI de tercera generación; y roblitinib, un inhibidor selectivo de FGFR4. El proceso de desarrollo es variado y se están usando diversas proteínas como dianas en distintas áreas terapéuticas que van desde trastornos autoinmunes como la artritis reumatoide o la alopecia areata hasta otros trastornos como la obesidad y la osteoartritis, aunque los tratamientos para el cáncer siguen dominando el panorama. Esta variedad da testimonio del potencial de la inhibición covalente, posibilitada por las nuevas herramientas y técnicas, como unas sofisticadas plataformas de cribado y el descubrimiento basado en la quimioproteómica. Estas tecnologías permiten a los investigadores cribar enormes bibliotecas de compuestos y visualizar directamente las interacciones covalentes en el proteoma. Cabe esperar que surjan inhibidores covalentes aún más precisos y potentes de la mano de estas innovaciones.
El avance de los inhibidores covalentes marca un punto de inflexión en el desarrollo de fármacos. Su capacidad de formar enlaces duraderos con las proteínas diana, sumada a los avances tecnológicos, ha preparado el terreno para una nueva era terapéutica. Dados los avances constantes de la investigación en este campo, los inhibidores covalentes presentan un gran potencial para revolucionar el tratamiento de varias enfermedades y mejorar las vidas de los pacientes. Para obtener más información sobre los inhibidores covalentes y conocer la visión de los expertos sobre algunas tendencias clave a las que conviene prestar atención, vea nuestro seminario web o lea el artículo publicado recientemente en ChemRXiV. Si desea profundizar en otros temas relacionados con el cáncer, explore nuestro análisis detallado sobre los inhibidores de RAS o lea acerca de la degradación selectiva de proteínas y los pegamentos moleculares.