Hasta diciembre de 2021, se habían administrado más de 8000 millones de dosis de vacunas para la enfermedad por coronavirus 2019 (COVID-19), entre las que se incluyen alrededor de 217 millones de dosis de refuerzo. El objetivo principal de estas vacunas es la denominada “proteína de la espícula” o “proteína S”, una proteína vírica esencial que desempeña un importante papel en la capacidad del virus para invadir las células huésped.
Aunque las vacunas son imprescindibles, el desarrollo de tratamientos para la COVID-19 ha revelado que las proteínas intrínsecamente desestructuradas pueden tener una función patológica crucial. En el pasado, los biólogos creían que la secuencia de aminoácidos de cada proteína determinaba su estructura tridimensional, que, a su vez, definía su función. Sin embargo, existe un amplio grupo de proteínas y regiones de las proteínas que carecen de una estructura tridimensional fija u ordenada, pero que llevan a cabo actividades biológicas esenciales. Se conocen como proteínas y regiones intrínsecamente desestructuradas (Figura 1).
Este desorden proteínico está codificado en las secuencias de aminoácidos y abunda en todos los organismos vivos y en los virus. Una comprensión más profunda de estas peculiares regiones de las proteínas del SARS-CoV-2 podría agilizar el desarrollo de tratamientos para la COVID-19.
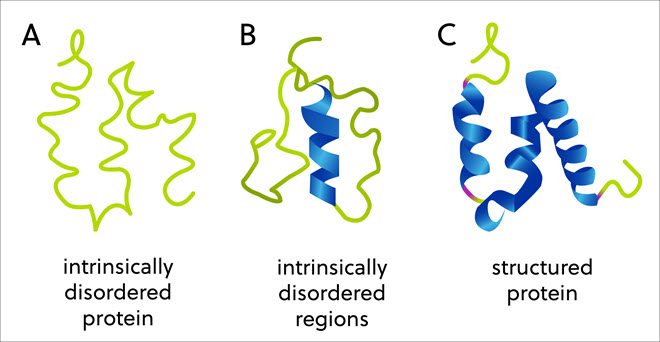
Ejemplos de proteínas intrínsecamente desestructuradas
La variabilidad natural que se da en las “proteínas intrínsecamente desestructuradas” (IDP) o en las “regiones intrínsecamente desestructuradas” (IDPR) de las proteínas se puede encontrar en los tres reinos de los seres vivos. Estas proteínas y regiones tienen relación con procesos importantes como la catálisis enzimática, la regulación alostérica, la señalización celular y la transcripción, entre otros.
Sin embargo, también desempeñan un papel clave en algunas enfermedades, como la neurodegeneración, la diabetes, las enfermedades cardiovasculares, la amiloidosis, las enfermedades genéticas y el cáncer. Además, las proteínas víricas suelen contener este tipo de regiones, que se han correlacionado con la virulenciaya que dotan a las proteínas del virus de la capacidad de unirse a las proteínas del huésped de una forma sencilla y con un alto grado de promiscuidad.
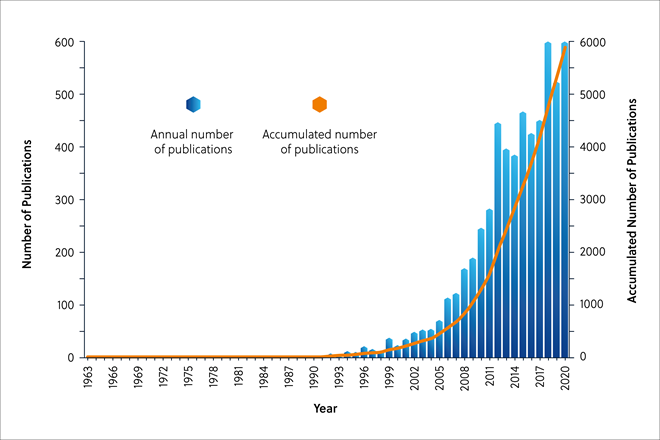
Desde el año 2000 se ha registrado un rápido aumento del interés por las IDP e IDPR en la ciencia de las proteínas, como demuestra una búsqueda en CAS Content CollectionTM (Figura 2). Además, se está empezando a explorar su papel en el diseño de medicamentos, incluidos los empleados para tratar la COVID-19.
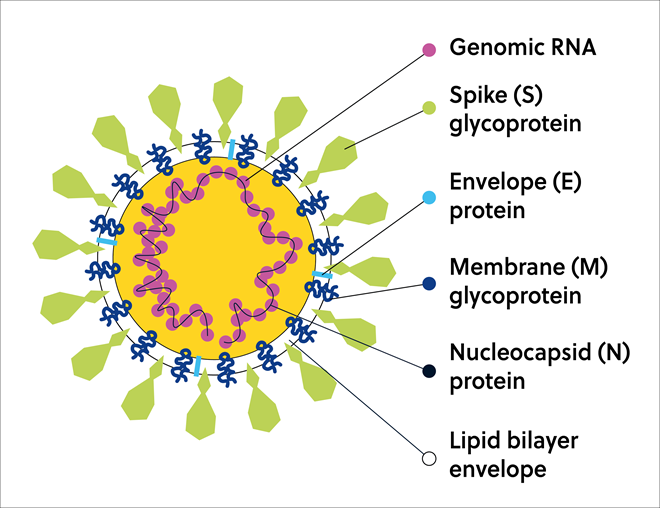
Proteínas intrínsecamente desestructuradas del SARS-CoV-2
El SARS-CoV-2 forma un virión que contiene el ARN genómico empaquetado en una partícula integrada por la proteína de la espícula (S), importante para la entrada del virus en las células huésped; la proteína de la membrana (M), que facilita el ensamblaje del virus; la pequeña proteína de la envoltura de canales iónicos (E), y la proteína de la nucleocápside (N), que se ensambla con el ARN vírico para formar la nucleocápside (Figura 3).
Las IDP e IDPR no son comunes en el proteoma del SARS-CoV-2. De hecho, el proteoma del SARS-CoV-2 presenta un nivel considerable de orden estructural. Con la salvedad de la proteína de la nucleocápside (N), las proteínas del SARS-CoV-2 son proteínas muy ordenadas que contienen un número reducido de regiones de proteínas intrínsecamente desestructuradas. Hay que destacar, sin embargo, que las regiones desestructuradas existentes contribuyen de forma significativa al funcionamiento y la virulencia del virus, lo que las convierte en dianas farmacológicas prometedoras para el descubrimiento de medicamentos antivirales. Esta estrategia ya ha demostrado su utilidad en la identificación de nuevos candidatos a fármacos.
La proteína de la nucleocápside (N)
La proteína N, que se une al ARN, estabiliza el ARN genómico en el interior de la partícula del virus y regula la transcripción, la replicación y el empaquetamiento del genoma vírico. La proteína N tiene un alto grado de desorden: su porcentaje promedio de desorden intrínseco predicho es de alrededor del 65 %. Estas regiones desestructuradas parecen ser importantes para el mantenimiento de la nucleocápside y, por tanto, podrían servir como objetivos para el diseño de medicamentos. Las regiones desestructuradas de la proteína N también parecen importantes porque hacen posible la agregación de la proteína por medio de un proceso denominado “separación de fases líquida-líquida”, que podría ser una manera de interrumpir la formación natural de gránulos de estrés, fundamental para la inmunidad de la célula huésped. Por tanto, la interrupción del proceso de separación de fases líquida-líquida es prometedora para la intervención antiviral y ofrece nuevas dianas y estrategias para el desarrollo de medicamentos que permitan combatir la COVID-19.
La proteína de la espícula (S)
La proteína S adorna la superficie del virus como una corona. Es esencial para la entrada del virus en el huésped (Figura 4) y, como tal, se ha usado a menudo como objetivo farmacológico en el desarrollo de vacunas para la COVID-19. La unión con el receptor y la fusión de las membranas —los pasos iniciales de la infección— están relacionadas con regiones que presentan un alto grado de desorden intrínseco.
El análisis de la proteína S indica que tanto los sitios de escisión de la subunidad S asociados a la maduración de la proteína S como el péptido de fusión de esta proteína están vinculados con las IDPR. Teniendo en cuenta que la digestión proteolítica es bastante más rápida en las regiones desestructuradas de las proteínas que en las estructuradas, esta especificidad estructural de la proteína de la espícula del SARS-CoV-2 podría tener una gran importancia funcional.
Durante la infección con el virus SARS-CoV-2, se pueden detectar IDPR en la interfaz entre la proteína de la espícula y el receptor ACE2, presente en los tejidos humanos a los que se une el virus. Los principales residuos de la proteína de la espícula tienen una elevada afinidad de unión con el receptor ACE2, lo que podría explicar la alta transmisibilidad del SARS-CoV-2.
Por tanto, la unión con el receptor y la fusión de las membranas —los pasos iniciales y fundamentales de la infección por coronavirus— están relacionadas con regiones de la proteína de la espícula que presentan un alto grado de desorden intrínseco. Son metas prioritarias para inhibir la infección por SARS-CoV-2.
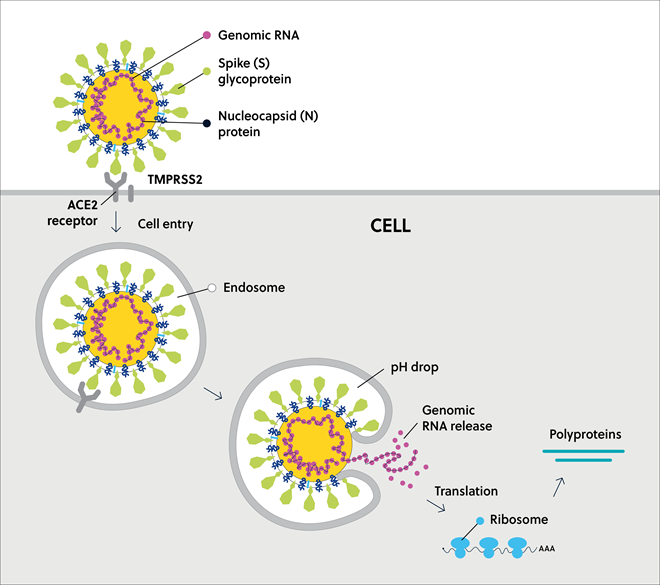
La proteína de la membrana (M)
La proteína M es una importante proteína transmembrana que abunda en el virión. El SARS-CoV-2 tiene una de las envolturas protectoras exteriores más resistentes encontradas en los coronavirus, lo que podría estar relacionado con el bajo desorden intrínseco de la proteína M (6 %) y explicar el alto grado de resiliencia y transmisibilidad del virus. De hecho, se ha comprobado que existe una correlación entre la virulencia de algunos virus y el porcentaje de desorden intrínseco de sus proteínas M, de tal modo que las proteínas M menos desestructuradas se asocian con virus más contagiosos.
Una mirada al futuro: las fronteras del diseño de medicamentos
La aparición de nuevos virus y de epidemias relacionadas con ellos en distintos lugares del mundo se ha convertido en una preocupación prioritaria. Por ello, conocer las estructuras y las funciones de las proteínas de los virus es primordial para identificar nuevas dianas terapéuticas que ayuden a prevenir y tratar las enfermedades.
En el artículo revisado por pares publicado en ACS Infectious Diseases, resumimos la información disponible sobre el proteoma del SARS-CoV-2 en relación con la presencia de desorden intrínseco en sus proteínas. De hecho, se ha reconocido que el proteoma del SARS-CoV-2 presenta un nivel considerable de orden estructural: solo la proteína N tiene un alto grado de desorden. Aunque otras proteínas del SARS-CoV-2 se caracterizan por un grado inferior de desorden, las IDPR existentes en ellas desempeñan un papel importante en el funcionamiento y la virulencia del virus, lo que las convierte en dianas prometedoras para el diseño de medicamentos antivirales.
Las IDP son muy comunes y tienen numerosas funciones biológicas cruciales que complementan la funcionalidad de las proteínas ordenadas. Sin embargo, cuando se producen fallos funcionales (como alteraciones de la expresión, el procesamiento o la regulación), las IDP e IDPR suelen participar en interacciones no deseables y en el desarrollo de diversos estados patológicos. De hecho, muchas proteínas asociadas con la neurodegeneración, la diabetes, las enfermedades cardiovasculares, la amiloidosis y las enfermedades genéticas, así como la mayoría de las proteínas relacionadas con el cáncer humano, son IDP o contienen IDPR largas.
Aunque se pueden utilizar técnicas de biología estructural en el desarrollo de medicamentos, la práctica del diseño farmacológico racional ha minusvalorado tradicionalmente la presencia de desorden intrínseco en las dianas proteínicas. Entender la estructura de estas regiones en el proteoma del SARS-CoV-2 y el proteoma de otros patógenos puede ser enormemente beneficioso para el desarrollo de medicamentos para la COVID-19 y otras enfermedades, y contribuirá a seguir ampliando las fronteras del diseño de fármacos.