
Une percée dans la nanotechnologie accélère la production de vaccins
Alors que les contaminations à la COVID-19 remontent régulièrement sous l'effet du variant Delta, les données indiquent toujours que les vaccins sont efficaces pour prévenir les hospitalisations et les décès. Plus de 4 milliards de doses de vaccin ont été administrées à travers le monde, mais seuls 27 % de la population mondiale et 1,1 % des habitants des pays à faibles revenus ont reçu au moins une dose de vaccin contre la COVID-19. Parmi les nombreux défis liés à la chaîne d'approvisionnement concernant la production et la distribution de ces vaccins (réfrigération, coûts et transport), une difficulté en particulier porte sur la production de nanoparticules lipidiques destinées aux vaccins.
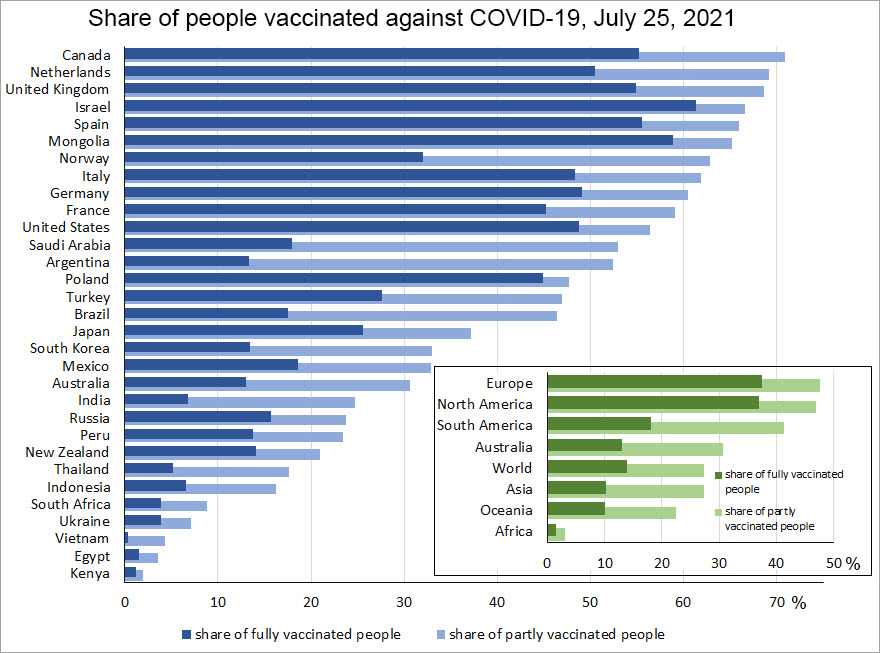
Figure 1 : Présentation détaillée par pays et par continent du pourcentage de personnes vaccinées
Pourquoi les nanoparticules lipidiques sont-elles essentielles aux traitements par ARNm ?
L'administration de traitements à ARNm dans le corps humain a constitué un défi majeur en raison de l'instabilité inhérente et des propriétés de l'acide nucléique :
- La charge négative et l'hydrophilie empêchent la diffusion passive entre les biomembranes.
- L'association à des protéines sériques, l'absorption par des phagocytes et la dégradation par des nucléases endogènes nuisent à une administration efficace.
- Des vecteurs d'administration sont nécessaires pour les protéger de la dégradation et les envoyer vers les cellules cibles pour une absorption efficace.
Les nanoparticules lipidiques (NPL) se sont avérées efficaces pour protéger parfaitement et transporter l'ARNm jusqu'aux cellules, comme l'ont prouvé les récents vaccins à ARNm contre la COVID-19.
La production de vaccins est limitée par la production de nanoparticules lipidiques
La mise à l'échelle de la production de tout traitement est toujours difficile, mais la production de ces nanoparticules lipidiques pour répondre à la demande mondiale de vaccins représente un défi considérable. La synthèse des lipides cationiques ionisables exclusifs, spécialement développés et optimisés pour ces vaccins, est un processus complexe en plusieurs étapes. Toutefois, il existe un défi encore plus important pour la production de NPL à grande échelle : la tâche consistant à combiner les lipides et l'ARNm pour former des nanoparticules.
En fait, pour produire de manière efficace une formulation pharmaceutique, la technique de fabrication est d'une importance majeure. Les méthodes traditionnelles de production de NPL, notamment l'hydratation à film mince, l'évaporation en phase inverse, l'injection de solvants et l'élimination des détergents, aboutissent généralement à des particules de grande taille (> 100 nm) et hétérogènes à faible rendement d'encapsulation, ce qui requiert une étape de réduction supplémentaire, comme l'extrusion ou la sonication. De plus, ces méthodes sont difficiles à mettre à l'échelle et ne sont pas faciles à reproduire systématiquement.
La microfluidique constitue une nouvelle approche
Récemment, la microfluidique s'est avérée efficace pour produire des NPL. Dans la méthode de concentration microfluidique, un flux de solution lipidique dans de l'alcool est envoyé dans un canal qui est entrecoupé et enrobé d'un flux coaxial en phase aqueuse (Figure 2A). La diffusion réciproque de l'alcool et de l'eau à travers l'interface alcool/eau entraîne une précipitation des lipides, qui s'assemblent automatiquement pour former des NPL. Les techniques microfluidiques sont robustes, évolutives et hautement reproductibles. Pour les formulations de vaccins à ARNm, le mélange lipidique inclut un lipide cationique ionisable, ainsi qu'un PEG-lipide et des lipides assistants (phosphatidylcholine, cholestérol), tandis que la phase aqueuse contient l'acide nucléique. Le lipide cationique interagit avec l'acide nucléique chargé négativement, ce qui produit des NPL à forte efficacité d'encapsulation. Il est possible de produire des NPL de taille définie et à répartition de taille étroite en contrôlant avec précision les paramètres de fonctionnement de la microfluidique, comme le débit et les ratios de composants. Toutefois, la production avec ce processus est limitée (
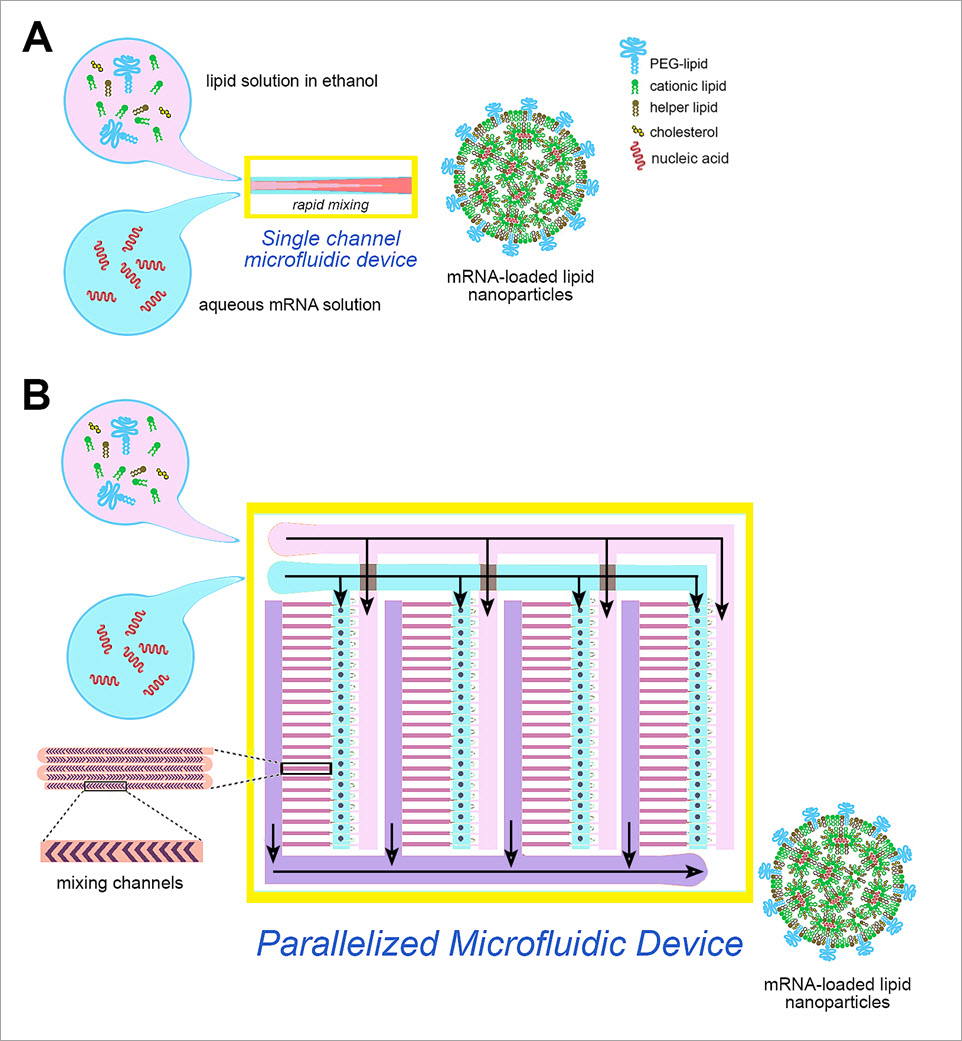
Figure 2. Un appareil microfluidique à canal unique (A) et un nouvel appareil microfluidique en parallèle (B) contenant 128 chambres de micro-mélange fonctionnant en parallèle
Les premiers résultats sont prometteurs
Une percée récente de la technologie de fabrication a permis de multiplier par plus de cent les taux de production de microfluidique. On a construit un appareil microfluidique contenant 128 chambres de micro-mélange fonctionnant en parallèle, un appareil microfluidique en parallèle qui utilise une technologie de plateforme d'intégration microfluidique à très grande échelle (VLSMI). Les chambres mélangent des quantités précises de lipides et d'ARNm pour produire des nanoparticules lipidiques et une quantité d'ARNm encapsulé dont la taille est contrôlée avec précision. L'appareil possède un débit plus de cent fois supérieur à celui d'un appareil microfluidique à canal unique (18,4 l/h) et offre d'excellentes possibilités pour une mise à l'échelle encore supérieure, ce qui permettrait la production en masse de nanoparticules lipidiques porteuses d'ARN. Les résultats publiés indiquent que l'appareil microfluidique en parallèle produit des nanoparticules lipidiques efficaces pour une utilisation dans des traitements et des vaccins à base d'ARNsi et d'ARNm.
La production de nanoparticules lipidiques permettra de réaliser de nouveaux traitements à ARNm
Le développement de tels vaccins et traitements pourrait révolutionner la médecine grâce à des traitements par édition génétique et de remplacement de protéines. Actuellement, des vaccins à ARNm basés sur des NPL sont en phase d'essai clinique pour le traitement d'un certain nombre de maladies infectieuses, comme les vaccins à ARNm à nucléosides modifiés contre le virus Zika, le cytomégalovirus, la tuberculose et la grippe. Les traitements à ARNm possèdent un gros potentiel dans l'immunothérapie dans le traitement des cancers tels que le mélanome, le cancer des ovaires, le cancer du sein et d'autres tumeurs solides.
L'utilisation de l'ARNm pour l'expression des protéines thérapeutiques est porteuse de grandes promesses dans le traitement d'un large éventail de maladies par l'application d'une thérapie de remplacement de protéines. Cette nouvelle technologie de fabrication microfluidique répond au besoin clinique d'une production de NPL évolutive, de grande précision et reproductible, permettant ainsi la formulation rapide de NPL pour un grand nombre de traitements et de vaccins à ARN. Même si cela ne permet pas de résoudre complètement le problème lié à la distribution mondiale, il s'agit d'un progrès considérable dans une nouvelle ère de traitements et de vaccins potentiels que l'ARNm pourrait rendre possibles.
