
世界保健機構がCOVID-19のパンデミック宣言をして以来、研究者はこの疾患の原因となる新型コロナウイルスSARS-CoV-2について、膨大な量の研究をしてきました。 しかし、多大な努力と投資にもかかわらず、COVID-19の効果的な治療薬はいまだ見出されていないのが現状です。 世界中で複数のワクチン候補が臨床研究段階に進みましたが、仮に安全で効果的なことが証明されても、ワクチンの製造と配布、世界中の人々への接種には何か月もの、何年もの期間が必要となります。 そのため、パンデミックが終息する前に増加が予想される多くの患者でウイルスの影響を軽減できる効果的な抗ウイルス治療薬の特定が、今でも早急に必要とされています。
この緊急のニーズに対応するため、科学者たちは各種の方法で創薬プロセスの迅速化を図っています。その中には、他の適用で承認済みで、COVID-19の治療に効果的かもしれない薬を特定する、コンピューターの手法の使用も含まれます。 この取り組みを支援するため、CASの科学者と技術者のグループは、定量的構造活性相関(QSAR)法を使用し、SARS-CoV-2の優先標的タンパク質を対象に機械学習モデルによりCOVID-19の治療候補薬を特定しようと試みています。 この作業によりLopinavirやTelmisartanなど、現在臨床的に有効性を示している薬がいくつか特定されましたが、これは最近ACS Omegaで公開されています。
古い手法と新しい手法
新薬の製品化には膨大な時間とコストが必要となるため、緊急に薬が必要とされる現在、既存の小分子薬のドラッグリパーパシング(既存薬再開発)は魅力的な代替策です。 治療薬をより早く提供できることに加えて、この戦略には従来の創薬プロセスに比べて数多くの利点があります。例えば、開発後期になって重大な副作用が見つかるなどのリスクが低減できます。
ドラッグリパーパシング(既存薬再開発)は新たな概念ではありません。 しかし、現在までの応用は大部分体系的ではなく偶発的なものでした。 ViagraやMinoxidilなど、ドラッグリパーパシング(既存薬再開発)の顕著な成功例では、新しい適用が見つかったのは、患者が予想外の副作用を報告したことが原因です。 最近では、より体系的なドラッグリパーパシング手法が導入されています。これにはシグネチャの一致、分子ドッキング、遺伝的関連解析、経路マッピング、後向き臨床分析などコンピューターを使用した手法が含まれます。 現在望まれているのは、コンピューターの使用により、新しく特定された薬物標的に既存の小分子治療薬を信頼性の高い形で関連付けることです。
ターゲットを絞り込む
コロナウイルスとは、人や多くの種類の動物で軽度から中等度の上気道疾患を引き起こすことで長らく知られているウイルスの大分類です。 動物固有のコロナウイルスが人に感染して伝染するのは稀ですが、現在までに3種類のコロナウイルス(SARS-CoV-1、MERS-CoV、新しい SARS-CoV-2)で感染が確認されています。 3種類とも蝙蝠由来のベータコロナウイルスと考えられます。 これらのウイルスとヒトへの感染方法の類似性から、以前のSARSとMERSに関する研究がSARS-CoV-2の薬剤標的を見つける上で素晴らしい開始点となります。 SARS-CoV-2の全タンパク質のうち、キモトリプシン様プロテーゼ(3CLpro)とRNA依存性RNAポリメラーゼ(RdRp)はQSARモデリングに理想的なタンパク質ターゲットとなります。SARS-CoVとMERS-CoVや、他の既知のコロナウイルスで見つかるタンパク質と共有している大きな類似点がその理由の一つです。
3CLproは、コロナウイルスがポリタンパク質ペプチドを分割して個別機能を持つ非構造タンパク質(NSP)を生成するために必要なプロテアーゼの一種です。 アミノ酸配列とタンパク質の構造を比較したところ、3CLproはSARS-CoV-2とその他のヒトコロナウイルスとで高度に保存されていることがわかりました。 SARS-CoV-1とは 96%の配列が一致していることが特定され、MERS-CoVとは87%、ヒトコロナウイルスとは90%でした。 したがって、以前のコロナウイルス関連研究で見つかった3CLpro抑制物質、および関連する構造活性相関(SAR)データは、SARS-CoV-2 3CLproの新しい抑制物質を見つける機械学習モデルのトレーニングに有用です。
RdRpは、RNAウイルスが宿主細胞内でウイルス遺伝子を複製する際に使用される主な酵素の一種です。 SARS-CoV-2 RdRpの構造研究と配列分析により、この酵素はSARS-CoV-1 RdRpの構造に非常に類似しており、HCVなど、大部分のウイルスのRdRpに残存する主なアミノ酸残基をいくつか含むことが明らかになりました。 幸運なことに、多様なウイルスのRdRpはRNAウイルスの抑制物質として、特にHCV関連の研究など、広範囲に研究が行われています。 したがって、HCVなどのRNAウイルスの既存のRdRp抑制物質は、SARS-CoV-2 RdRpの抑制について、創薬に貴重な情報を与えてくれる可能性があります。
機械学習で既存の治療薬を優先的に処理
機械学習モデルは、近年創薬を促進するために使用が広がっています。 具体的には、現在の創薬プロセスの最初のステップはQSARであることが多くなっています。 簡単に説明すると、QSARとは、化学物質の非常に複雑な生物学的特性と物理化学的特性を、その分子構造の量的測定値を元に、近似値を求める数学的モデルです。 このような数学的予測モデルは、特定された標的に対して有効な可能性の高い候補薬を優先的に研究するために、化学構造の膨大なデータベースをスクリーニングするために使用されています。 この方法では、化学物質の活性とその構造には直接的関連性があり、類似の構造的特長を有する分子は同じような物理特性や生物学的効果を有することを想定しています。
本研究で、私は同僚との協力を通じて、3CLproおよびRdRpのタンパク質ターゲットの高度なQSAR予測モデルを構築しました。 コンピューター科学者と化学者を含むチームは、モデルのトレーニング対象の分子として、構造生物活性データを持つ1,000種以上の抑制物質を選定しました。 データは最新のSARS-CoV-2生物検体の研究およびSARS-CoV-1、MERS-CoV、CASコンテンツコレクションのその他の関連ウイルスに関する既存の研究から収集しました。 これらのデータに各種の機械学習アルゴリズムを適用して、数10個のQSARモデルを構築しました。その中から、3CLproとRdRpをそれぞれ標的にした最も成果の優れたモデルを1つずつ選定しました。
COVID-19および関連ウイルス感染の治療効果を持つ可能性があるウイルスの3CLproおよびRdRp標的化合物を特定するQSAR機械学習モデルとその応用に関する文献全文を読んで、テストされた全モデルと最も有望な候補薬をご確認ください。
得られた2つのQSARモデルを使用して、1,087種のFDA認可済みの薬、CAS COVID-19抗ウイルス薬候補化合物データセットの50,000件近くの物質、2003年以降に発行されたSARS、MERS、COVID-19関連文献でCASにより薬理学的活性が特定/薬剤としての役割がインデックス化された113,000件未満の物質を含む、膨大な候補薬をスクリーニングしました。 物質構造の機能としてプロテアーゼの抑制活性をモデル化することで、コロナウイルスの3CLproとRdRpの有効な抑制剤として予測されている物質の中から、最も有望な候補をいくつか特定しました。 また、私たちのモデルがSARS-CoV-2の3CLproまたはRdRpを抑制すると予測した物質の多くは、より重篤なCOVID-19感染の危険因子であることが明らかになった他の疾患に対する治療活性を有することも既に認められています。 例えば、塩酸ジルチアゼム(Cardizem)など、心疾患にも活性を有することが知られているCOVID-19の抗ウイルス薬候補は、特定の症例では二重の利点をもたらす可能性があります。
これらのモデルは、ROC-AUC(受信者動作特性曲線の下の面積)、感度、特異性、確度が高いことが検証されています(図1)。 この研究が完了した時点で、同モデルで高い活性を有すると予測された分子の一部は既に出版済みの実験的生物検定研究と臨床試験で検証されおり、この予測能力の正しさを更に裏付けています。
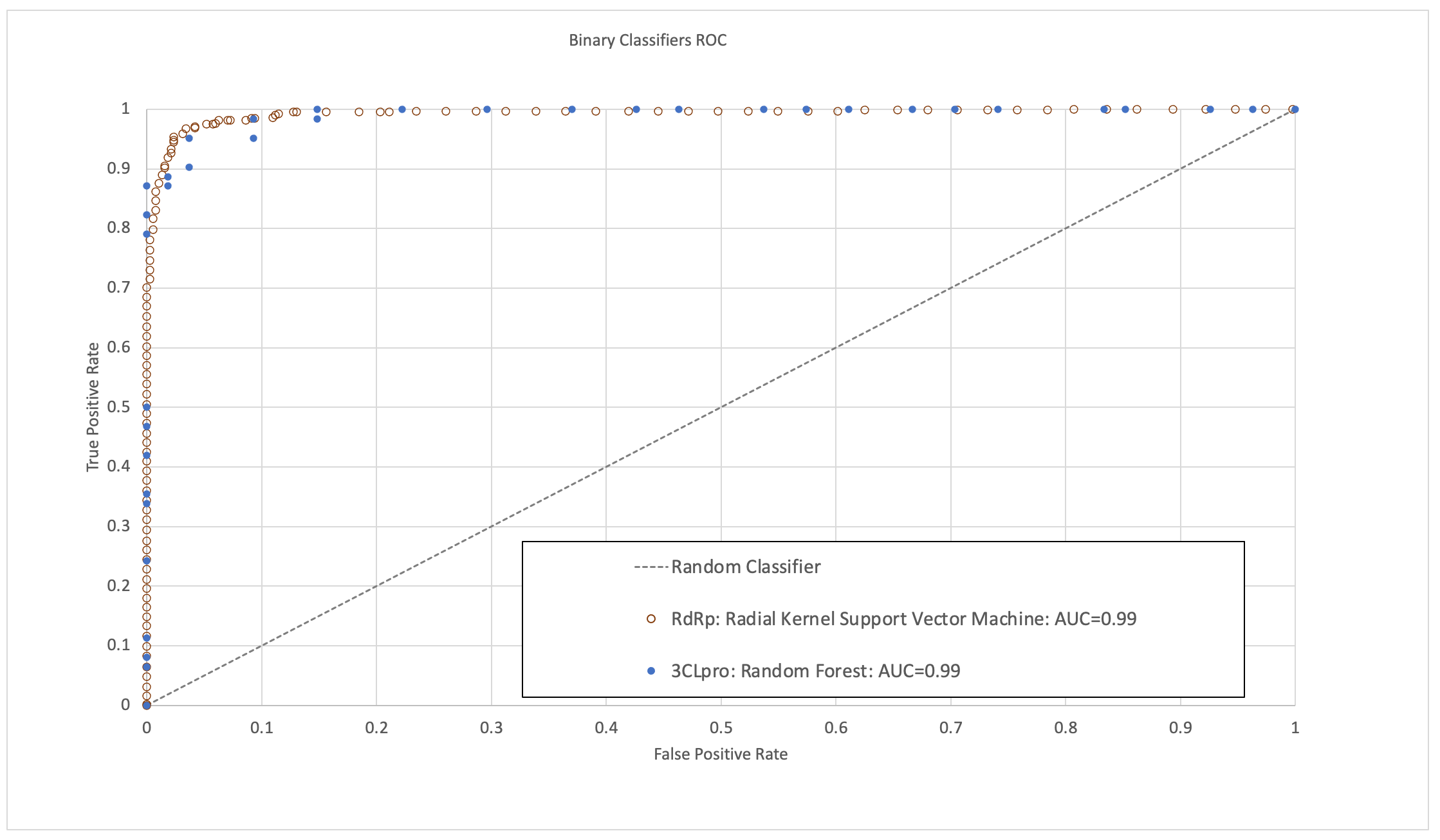
次のパンデミックに備える
本研究は現在のCOVID-19の危機で治療効果を有する可能性がある化合物を特定することに注力したものですが、今後もウイルス由来の新たなパンデミックが起こる可能性も無視できません。 従って、将来の爆発的感染に対する準備を今すぐ開始し、抗ウイルス薬研究に十分に投資して、全力を傾け続けることが現在の急務です。 異なる種類のウイルス(コロナウイルス、インフルエンザウイルス、エボラウイルス、レトロウイルスなど)が大流行する可能性があり、それぞれの新薬と新しい適用の人に対する安全性と有効性のテストには多大な時間が必要となるため、広範囲にわたる抗ウイルス薬とワクチンは非常に価値のあるものになります。
ここで説明した機械学習の手順、分子ドッキング、仮想スクリーニングなど、コンピューターを使用した創薬手法の継続的開発は、その中でも特に重要になるでしょう。 コンピューターの処理能力の絶え間ない向上、ドッキングと構造予測のアルゴリズムやタンパク質結晶構造の判断手法の継続的発展などにより、さらなる進歩が促進されます。 また、高スループットスクリーニング、オーミクス技術、既存薬再開発などの利用も、引き続き重要性を増していきます。 これらの新技術を用いた手法は決して人力による実験室での研究を置き換えるものではありません。効率を高め、補完し合うものになるでしょう。 人力によるデータの収集と機械学習モデルを組み合わせた、COVID-19の小分子候補薬を特定する取り組みは、創薬における人力と機会学習のシナジー効果に脚光を当てることになると共に、継続的なCOVID-19などの抗ウイルス薬研究の努力に貢献することになります。
グローバルな科学コミュニティーの一員として、CASは所有するすべての資産とリソースを活用してCOVID-19と戦います。 科学的な洞察、オープンアクセスできるCAS COVID-19リソース、特別報告書など、その他の関連リソースもご利用ください。
