
분자 접착제란?
분자 접착제는 작은 화학체로 근접성 유도 표적 단백질 분해(TPD)라는 혁신적인 전략을 사용하는데, 이 경우 병원성 관심 단백질(POI)이 천연 소화 효소와 연결되고 파괴됩니다(그림 1). 이 접근법을 활용하면 POI를 보통 세포 폐기물 처리 시스템 역할을 하는 유비퀴틴 프로테아좀 시스템의 E3 유비퀴틴 리가아제와 효과적으로 연결할 수 있습니다. 이러한 접근법으로 완전히 새로운 모드를 가진 새로운 종류의 치료제가 개발되었습니다. 이러한 모드는 암, 염증 및 면역병, 감염 같은 다양한 중증 질환에 대해 흥미로운 잠재적 활동을 보이는데, 이들 중 다수는 병원성 단백질의 이상 발현이 기반이 됩니다. 오늘날에는 600개가 넘는 E3 유비퀴틴 리가아제가 인간 게놈에 암호화되어 있으며 지금까지 TPD 접근법을 통해 소수의 리가아제만 개발되었는데, 앞으로 훨씬 더 많은 개발 가능성이 있습니다.
2022년 10월 5일 오후 2시(EDT)에 Dana-Farber의 전문가, Neomorph의 CEO, 그리고 CAS가 분자 접착제, 표적 단백질 분해, 유도 근접성의 최신 트렌드를 살펴보는 라이브 ACS 웨비나에 참여하여 궁금한 점을 문의할 수 있습니다. 여기에서 등록하십시오.
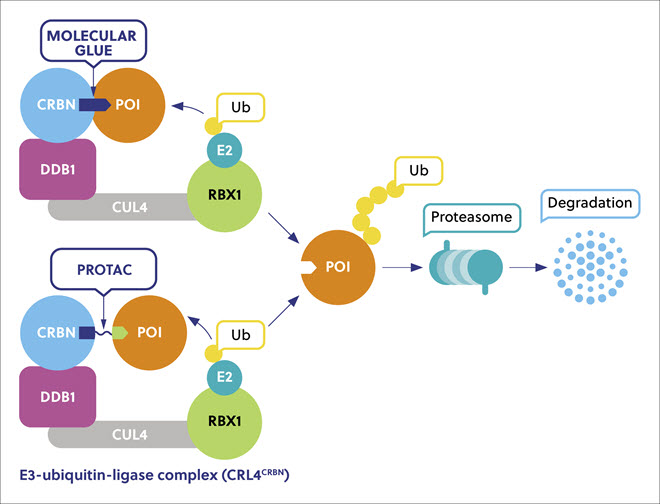
경쟁적인 점유가 아닌 일시적인 결합 수단을 통해 활동하며 POI의 폴리유비퀴틴화를 촉진한 후에 분리되므로 단백질 분해제를 사용하는 것이 유리합니다. 따라서 하나의 분해제가 다수의 병원성 단백질 사본을 파괴하여 이전에는 '약물 개발이 불가능했던' 단백질에 비해 적은 투여량으로 효율성을 높일 수 있습니다. 단백질 억제제는 병원성 단백질의 활성 부위를 차단하지만 분해제는 모든 기능을 제거하므로, POI에 대한 감도가 더 높아지고 비효소적 단백질 상호작용에 영향을 미칠 가능성이 더 커집니다.
지난 20년 간 치료 목적으로 유비퀴틴 기반 자연 단백질 분해를 사용하는 TPD 복합체 개발이 크게 발전했습니다. 치료를 위해 POI를 E3 리가아제와 연결하는 키메라 분해제의 첫 특허는 1999년에 Proteinix가 출원했습니다. 이후 개념 증명 연구가 시작되었으며 해당 연구에서 PROTAC(Proteolysis-Targeting Chimera)를 통해 암 관련 단백질을 성공적으로 분해했습니다. 초기의 PROTAC는 대형 분자 구조에 해당했으며 nutlin-3을 MDM2 모집에 사용하는 소형 분자 안드로겐 수용체(AR) 분해제에 대한 분자 최초의 보고서는 2008년에 발표되었습니다. 이후 HIF1α 펩타이드의 소형 분자 유사제가 발견되면서 소형 분자 PROTAC의 합리적인 설계 속도가 빨라졌습니다. 지금까지 소수의 접근성 유도 TPD가 임상 시험 단계에 도달했지만 안드로겐 및 에스트로겐 수용체를 표적으로 삼는 두 개의 PROTAC(ARV-110 및 ARV-471)는 II상 시험까지 진행되었으며 현재 그 외 여러 요소가 개발 중에 있습니다.
분자 접착제와 PROTAC는 각기 다른 속성을 가집니다. 분자 접착제는 예측하기 어려운 다양한 표적 단백질과 상호작용하는 소형 분자로, 다른 방식으로는 서로에 대한 고유한 관련성을 보여 주지 않는 두 단백질의 상호작용을 유도하고 개선해 특징적인 생물학적 활동을 보여 줍니다. PROTAC는 두 부분으로 구성된 이가분자로, 한 부분은 POI와 결합되고 다른 한 부분은 E3 리가아제와 결합되며 링커로 연결됩니다. 분자 접착제는 PROTAC보다 더 작으며 PROTAC보다 더 우수한 약리적 속성, 더 높은 막 투과성, 더 우수한 세포 흡수율 및 혈뇌 장벽 통과성이 강점입니다. 분자 접착제는 주로 뜻밖의 발견 덕분에 식별할 수 있었는데, 약물 개발이 불가능한 표적 단백질에 대한 합리적인 설계 접근법이 부상하고 있습니다. 초기 발견 이후에 해당 경로는 스캐폴드 정의, 최적화, 검증으로 이어집니다(표 1).
표 1. 분자 접작체 분해제 발견 경로 및 구조 안내 약물 설계.
| 초기 개발 | 스캐폴드 정의 |
| 최적화 | 검증 |
다양한 유형의 분자 접착제가 발견되었으며 가장 잘 알려진 것은 아마도 탈리도마이드와 관련 유사물질, 그리고 E3 리가아제 세레블론을 표적으로 삼는 레날리도마이드와 포말리도마이드입니다. 분자 접착제는 다양한 다른 활동 메커니즘을 통해 식별되었는데, 여기에는 자가포식 매개 단백질 분해, MEK 하위 복합체 안정화, KRAS 돌연변이 억제, α-튜불린 중합 안정화, FK506 결합 단백질 12(FKBP12) 분해가 포함됩니다.
분자 접착제 연구 동향 - 출처: CAS Content Collection™
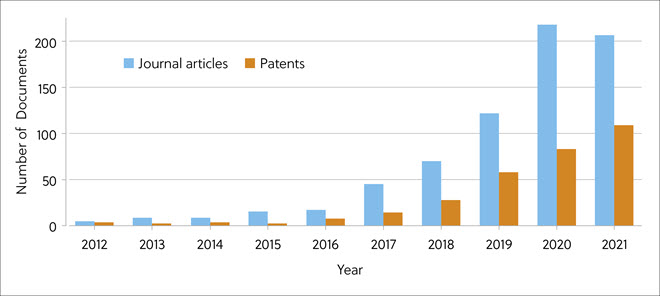
CAS Content Collection™은 엄선된 최대 규모의 과학 정보 컬렉션으로 시간, 연구 분야, 제형, 응용 부문, 화학적 성분 같은 변수를 대상으로 전 세계 과학 간행물의 정량 분석을 수행하는 데 적합합니다. 의료 화학 및 신약 개발에 초점을 맞춰 분자 접착제 연구의 최신 발전 상황을 평가하기 위해 새로운 CAS 통찰력 보고서가 2012년 ~ 2021년을 기준으로 CAS Content Collection의 관련 간행물 데이터를 조사했습니다. 이 기간 동안 단백질 분해제와 관련된 논문 및 특허가 폭발적으로 증가했습니다(그림 2).
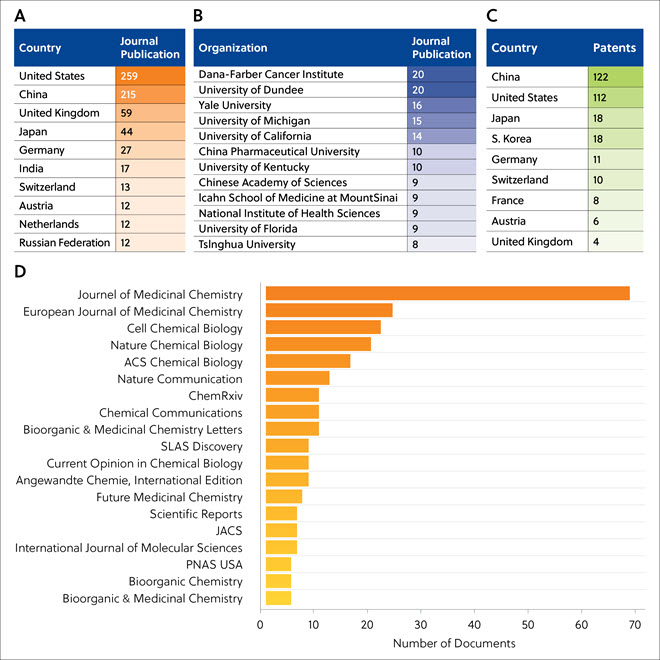
단백질 분해제에 대한 학술지 논문은 주로 미국, 중국, 영국, 일본, 독일 등에서 발표했습니다(표 2A). Dana-Farber Cancer Institute와 던디대학교가 TPD 관련 학술지 논문을 가장 많이 발표했습니다(표 2B). 단백질 분해제와 관련해 가장 많은 특허를 출원한 곳은 중국과 미국이었습니다(표 2C). TPD 관련 논문이 자주 수록된 학술지를 표 2D에서 확인할 수 있으며, 이는 의료 연구 부문에서 TPD가 가지는 중요성을 보여 줍니다. Journal of Medicinal Chemistry와 European Journal of Medicinal Chemistry에 가장 많은 TPD 관련 논문이 수록되었습니다.
표 2. TPD 관련 논문을 가장 많이 발표한 국가(A), 조직(B), 과학 학술지(D), 그리고 TPD 관련 학술지 논문을 가장 많이 출원한 국가(C).
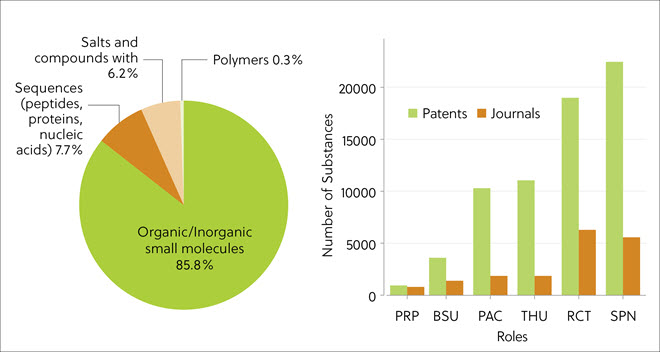
간행물에서 가장 자주 언급된 TPD 유형은 소형 분자(85.8%)였으며 펩타이드, 단백질, 핵산을 포함하는 바이오시퀀스(7.7%)와 소금이 있습니다(그림 3 왼쪽 패널). 이러한 현상은 펩타이드 기반이었던 초기 단백질 표적 키메라 분자로부터의 변화를 나타냅니다. 단백질 분해제는 다단계 화학 반응을 통해 합성되므로 논문 분석 결과에서 SPN(합성 준비) 및 RCT(반응물)의 합성 관련 역할이 우세적이라는 것을 알 수 있습니다(그림 3, 오른쪽 패널). 훨씬 더 많은 수의 특허 기반 화합물이 CAS Content Collection에 색인화되었습니다.
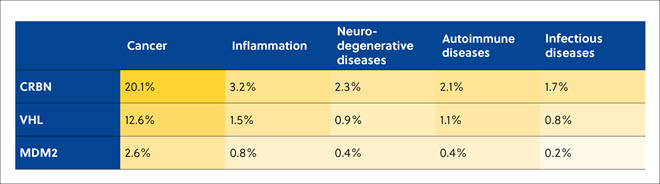
논문을 분석해본 결과, E3 리가아제 유형 중 CRBN, VHL, MDM2를 사용해 TPD를 동원하여 암, 염증, 신경변성, 자가면역, 감염성 질환과 관련된 표적 단백질의 후속 프로테아솜 분해와 유비퀴틴화를 유도하는 경우가 가장 많았습니다(표 3).
표 3. 가장 널리 사용되는 세 가지 E3 리가아제에 대한 CAS Content Collection의 단백질 분해제 관련 간행물 수와 표적 질환의 상관관계. 백분율은 단백질 분해제와 관련된 총 간행물 수를 기준으로 합니다.
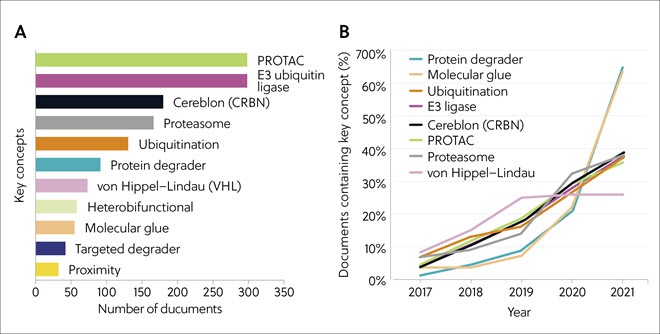
2017년 ~ 2021년 사이에 간행된 학술지에서 가장 많이 다룬 주제는 PROTAC와 E3 유비퀴틴 리가아제였으며 세레블론, 프로테아좀, 유비퀴틴화가 그 뒤를 이었습니다(그림 4A). 분사 접착제와 단백질 분해제에 대한 문서는 그 수가 적었으나 2019년을 기점으로 폭발적으로 성장하며 큰 주목을 받았습니다. 유비퀴틴화, E3 리가아제, 세레블론, PROTAC, 프로테아좀을 포함한 다른 개념들도 2017년 ~ 2021년 사이에 높은 성장세를 이어나갔습니다(그림 4B).
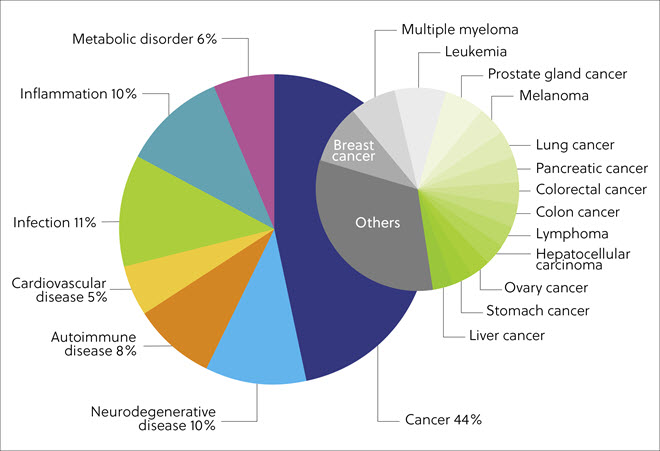
CAS Content Collection에서 단백질 분해제가 표적으로 삼은 질환을 분석한 결과 다양한 암(예: 유방암, 전립선암, 다발골수종, 백혈병)과 관련된 간행물이 가장 많은 부분(44%)을 차지했습니다. 감염성(11%), 신경변성(10%), 염증성(10%), 자가면역(8%), 대사(6%) 및 심혈관(5%) 질환도 상위권에 속했습니다(그림 5).
분자 접착제 - 발견과 개발
이미 분자 접착제의 유형과 구조가 많이 알려져 있으며, 그 수는 계속해서 증가하고 있습니다. 가장 광범위하게 조사된 분자 접착제는 E3 리가아제 CRBN과 DCAF15 관련 아릴 설폰아미드를 결합하는 소형 분자입니다. 다양한 비E3 리가아제 활동 메커니즘을 통해 단백질 분해를 유도하는 다른 분자 접착제로는 자가포식 매개 단백질 분해제, 단백질-단백질 상호작용 안정화제, KRAS 돌연변이 억제제, 미세소관 중합 안정화제, 그리고 mTOR(mammalian Target of Rapamycin) 억제제가 있습니다. 사이클로스포린 A와 분자 접착제의 역할을 하는 것으로 알려진 SFA(Sanglifehrin A) 같은 천연 화합물도 존재합니다. 이러한 전개는 분자 접착제 접근법의 유의미한 확장과 활동 범위의 다양화를 나타냅니다.
지금까지 수많은 잠재적 분자 접착제가 식별되었지만 임상에서는 극소수만 실제 치료 효능에 대한 평가를 마쳤으며 규제 승인을 받은 접착제의 수는 그보다 더 적습니다. 전 세계 많은 기업들이 다양한 암과 신경변성 및 염증성 질환에 사용할 수 있는 일련의 분자 접착제 제품들을 사전 임상 개발 단계에서 준비하고 있습니다. 이러한 기업을 간단하게 소개해 보겠습니다.
- Ranok(중국 항저우) - 2022년 상반기에 신약 후보 RNK05047이 고형종양과 림프종의 치료를 위한 임상 시험 단계에 들어갑니다
- Monte Rosa Therapeutics(미국 매사추세츠주 보스턴) - 종양 치료 등을 위해 GSPT1을 표적으로 삼는 주요 프로그램과 관련된 IND 준비 활동을 시작했습니다. 2022년 중반에 FDA에 IND 신청서를 제출할 예정입니다. 신약 개발 단계에서는 고형종양/액상종양, 자가면역 질환, 혈액 질환을 표적으로 삼는 다른 분자 접착제를 다룹니다
- Plexium/Amgen과의 파트너십 체결(미국 캘리포니아주 샌디에이고) - 면역 질환 및 암 치료를 위해 IKZF2 관련 세레블론 분자 접착제의 최적화 단계를 주도합니다
- Frontier Medicines/AbbVie와의 파트너십 체결(미국 캘리포니아주 샌프란시스코) - 난치성 면역 및 종양 표적 관련 소형 분자 공유약을 개발하기 위한 신약 개발 단계에 있습니다
- f5 Therapeutics(미국 캘리포니아주 샌디에이고) - 다양한 암, 다발성 경화증, 류마티스 관절염, 비알코올성 지방간염, 간 섬유증을 위한 분자 후보
- Ambagon Therapeutics/BMS 및 Merck와 파트너십 체결(미국 캘리포니아주 샌 카를로스) - 다섯 개의 초기 개발 종양 치료 화합물을 활용하여 신약을 개발하고 있습니다
- Amphista Therapeutics(영국 런던) – 비E3 리가아제 작용 양식을 통한 암 치료
- Proxygen/Boehringer Ingelheim과 파트너십 체결(오스트리아 빈) - 폐 및 위장암 치료를 위한 신약을 개발하고 있습니다
- Neomorph/Dana Farber Cancer Institute와 파트너십 체결(미국 캘리포니아주 샌디에이고) - 약물 개발이 불가능한 표적 관련 분자 접착제 개발 파이프라인을 발전시키기 위한 신약을 개발하고 있습니다
- Seed Therapeutics/Lilly와 파트너십 체결(미국 뉴욕) - 암, 신경병성 질환, 감염성 질환을 치료하는 분자 접착제 파이프라인 후보 관련 신약을 개발하고 있습니다. 주요 화합물은 KRAS 종양유전자를 표적으로 삼습니다
- Pin Therapeutics(대한민국 서울) – 신약 개발 중
- Venquis Therapeutics(미국 캘리포니아주 샌디에이고) - 암 및 변성 질환을 위한 신약을 개발하고 있습니다
- IRB Barcelona/Almirall과 파트너십 체결(스페인 바르셀로나) - 피부 질환을 치료하기 위한 신약을 개발하고 있습니다
- Shanghai Dage Biomedical Technology Co., Ltd(중국 상하이) - 분자 접착제 파이프라인이 암, 염증성 질환, 대사 질환과 관련된 표적을 처리합니다. 종양 분자 접착제 후보에 대한 최적화 단계를 주도합니다
- Triana Biomedicines(미국 매사추세츠 월섬) - 2022년 4월, 이성적으로 설계된 분자 접착제 파이프라인을 구축해 부적절하게 처리되던 질환을 치료할 목적으로 설립되었습니다
- Evotec/BMS와 파트너십 체결(독일 함부르크) - 분자 접착제 분해제 관련 파이프라인을 개발하기 위한 신약 개발 단계에 있습니다
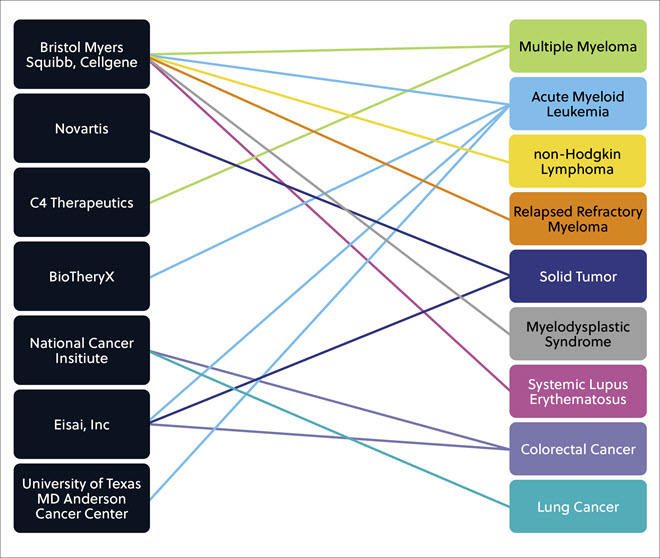
그 외 여러 기업/기관이 많은 임상 개발 단계에서 유망한 여러 분자 접착제 화합물을 개발하고 있으며, 이들의 목표는 광범위한 고형종양 및 액상종양과 염증성 질환, 그리고 전신홍반루푸스 같은 자가면역 질환을 치료하는 것입니다(그림 6).
분자 접착제 치료제의 전망 – 분자 접착제 치료제가 미충족 의료 요구를 충족할 수 있을까요?
분자 접착제를 사용하여 다른 방식으로는 가까워질 수 없는 표적 단백질이 분해 효소에 근접하도록 유도하는 접근법은 활용도가 굉장히 높으며, 이를 통해 광범위한 중증 질환에 대한 수많은 신규 치료제를 개발할 수 있습니다. 이제 TPD 접근법을 개발하기 위해 유용한 후보 화합물을 식별하고 이를 임상적 가치가 있는 제품으로 만들어야 합니다.
분자 접착제의 활동 메커니즘과 관련 설계 원리에 대한 이해도가 부족하며 새로운 화합물을 만들고 활용도를 극대화하기 위해서는 보다 깊이 있는 연구가 필요합니다. 새로운 분자 접착제를 발견하는 방식은 강도 높은 HTS와 체계적인 검증에 크게 의존해 왔습니다. 새롭고 보다 효율적인 화합물을 개발하는 환경을 개선하고 다양한 상황에서 역량을 평가하기 위해서는 효율적이며 합리적인 설계 전략이 필요합니다. 뜻밖의 발견에서 합리적인 설계로 전환하기 위해서는 분자 접착제 결합을 모델링 및 예측하기 위한 계산 도구와 단백질 도킹에 대한 이해도를 높이기 위한 결정화의 발전이 필요합니다.
CAS Content Collection의 검색 결과에 따르면 분자 접착제를 사용한 단백질 분해의 유도는 큰 주목을 받고 있으며 연구 논문과 특허 측면에서 폭발적인 성장세를 보이고 있습니다. E3 리가아제 표적 화합물이 계속해서 우위를 보이고 있지만 비E3 리가아제 화합물과 몇몇 천연 분자 접착제 분해제에도 많은 관심이 쏠리고 있어 앞으로 다양한 치료제가 개발될 가능성이 있습니다. 따라서 분자 접착제의 전망은 밝은 편인데, 머지않아 더 많은 치료제가 이 접근법을 사용해 개발될 것이며, 다양한 미충족 의학적 요구가 새롭게 충족될 가능성이 있습니다.
CAS 통찰력 보고서를 다운로드하여 분자 접착제 분해제의 폭발적인 성장세와 관련 치료제의 용도, 그리고 지난 10년간의 연구 주제 변천사에 대해 알아보십시오.
