分子糊とは
分子糊は、対象の病原性タンパク質(POI)を天然の消化酵素と結びつけて破壊する、標的タンパク質分解誘導剤(TPD)と呼ばれる画期的な戦略を用いる小さな化学物質です(図1)。 この方法は、普段は細胞の廃棄物処理システムとして機能しているユビキチンプロテアソーム系のE3ユビキチンリガーゼに、POIを効果的に「付着」つまり結びつけるものです。 この方法により、がん、炎症性疾患、免疫疾患、感染症など、病原性タンパク質の異常発現を原因とするさまざまな重篤な疾患に対して活性を示す、まったく新しい機序の治療薬群が生み出されています。 ヒトゲノムには600を超えるE3ユビキチンリガーゼがコードされていますが、TPDのアプローチが利用されているのは今のところごくわずかなため、今後さらに多くの種類が開発できる可能性があります。
2022年10月5日午後2時(東部標準時)に開催されるACSライブウェビナーでは、ダナ・ファーバー研究所やNeomorph社のCEO、およびCASの専門家が、標的タンパク質分解誘導剤の新たなトレンドについて考察します。 こちらで登録できます。
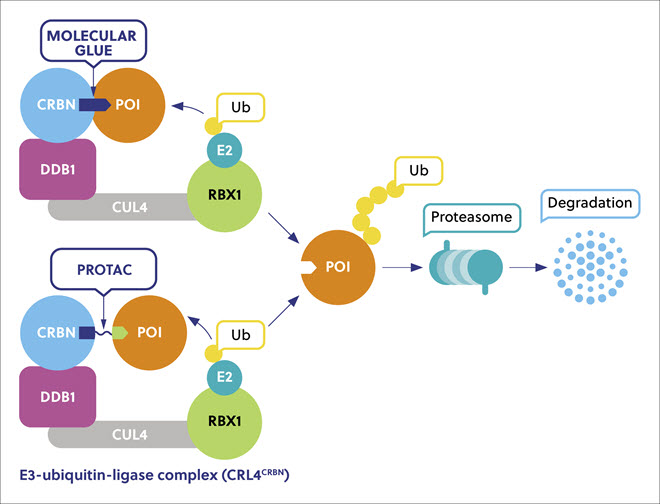
タンパク質ディグレーダー(分解誘導剤)のメリットは、競合的な占有ではなく、一過性の結合を介して作用し、またPOIのポリユビキチン化を促進した後に解離するところです。 そのため、1つのディグレーダーで多くの病原性タンパク質を破壊でき、低用量でこれまで「アンドラッガブル」だったタンパク質に高い効果を発揮できます。 タンパク質阻害剤は病原性タンパク質の活性部位をブロックするのに対し、ディグレーダーはその機能をすべて除去するため、POIに対する感度が高く、非酵素的なタンパク質相互作用に影響を与える可能性が高くなります。
治療を目的とした、ユビキチンを用いた自然なタンパク質分解を利用するTPD化合物の開発は、この20年間で大きく進展しています。 POIとE3リガーゼを結合させる治療用キメラ分解物の最初の特許は、1999年のProteinix社が出願したものです。 続いて、タンパク質分解標的キメラ(PROTAC)を用いてがん関連タンパク質の分解に成功した実証実験がありました。 初期のPROTACは高分子構造でした。低分子のアンドロゲン受容体(AR)のディグレーダーでMDM2のリクルートにnutlin-3を用いたものは、2008年に初めて報告されています。 その後、HIF1αペプチドの低分子模倣物質が発見され、低分子PROTACの合理的な設計が促進されました。 今のところ、TPDはほとんど臨床試験に至っていませんが、アンドロゲン受容体とエストロゲン受容体を標的とする2つのPROTAC(ARV-110とARV-471)は第2相試験まで進み、その他にも多くの開発中の製品があります。
分子糊とPROTACでは特性が異なります。 分子糊は、さまざまな標的タンパク質と相互作用する小分子ですが、その予測は困難です。本来は親和性を示さない2つのタンパク質の間の相互作用を誘発、増強することにより、異なる生物活性を示します。 PROTACは、POIとE3リガーゼに結合する2つの部位がリンカーで結合した2価の分子です。 分子糊は、PROTACと比べるとより小さいため、より優れた薬理特性のほか、より高い膜透過性、より優れた細胞への取り込み、そしてより高い血液脳関門の通過性などが期待されています。 分子糊の同定は主に偶然に頼っていましたが、アンドラッガブルなタンパク質を標的にする合理的な設計アプローチが登場しています。 初期探索に続いて、足場の定義、最適化、検証と進んでいます(表1)。
表1. 分子接着剤ディグレーダーの探索と構造誘導型薬物設計への道。
| 初期探索 | 足場の定義 |
| 最適化 | 検証 |
分子糊は、さまざまな種類が発見されています。その中でも最もよく知られているのはサリドマイドとその類似体、およびレナリドミドとポマリドミドで、これらはE3リガーゼのレブロンを標的にします。 分子糊は、オートファジーによるタンパク質分解をはじめ、MEK部分複合体の安定化、KRAS変異抑制、αチューブリン重合安定化、そしてFK506-結合タンパク質12(FKBP12)分解など、他にもさまざまな作用機序との関連で同定されています。
CAS コンテンツコレクション™から見た分子糊研究の展望
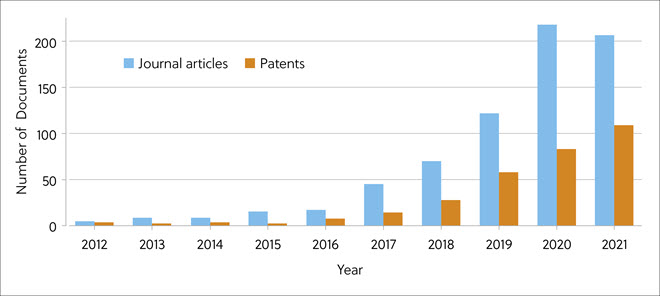
CAS コンテンツコレクション™は、出版公表された科学知識を人間が収集したものとしては世界最大のコレクションで、時間、研究分野、処方、用途、化学組成などの変数を用いて世界の科学出版物を定量分析するのに適しています。 分子糊、特に医薬品化学と創薬における研究の最近の進歩を評価するため、新しいCAS Insights Reportでは、2012年から2021年までの関連出版物データをCAS コンテンツコレクションを使って調査しました。 その結果、この期間中は、タンパク質ディグレーダーに関連する論文や特許が爆発的に増加したことが判明しました(図2)。
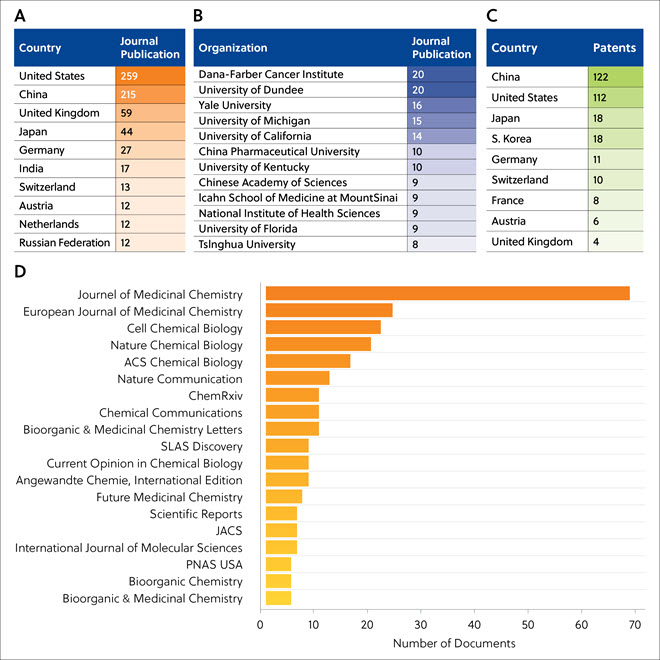
タンパク質ディグレーダーに関する学術論文は、米国、中国、英国、日本、ドイツなどの国が多くなっています(表2A)。 TPD関連の学術論文を最も多く発表しているのは、Dana-Farber Cancer InstituteとUniversity of Dundeeです(表2B)。 タンパク質ディグレーダー関連の特許出願件数が最も多いのは、中国と米国でした(表2C)。 TPD関連の論文を頻繁に掲載している雑誌を表2Dに示します。医学研究におけるTPDの重要性が強調されており、Journal of Medicinal ChemistryとEuropean Journal of Medicinal Chemistryが最も多くのTPD関連論文を掲載しています。
表2. TPD関連論文を発表している上位の国(A)、組織(B)、科学ジャーナル(D)、およびTPD関連特許を出願した上位の国(C)。
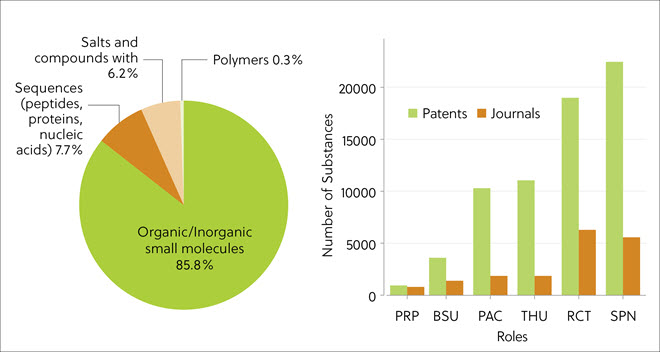
論文で最も多く言及されているTPDの種類は低分子(85.8%)で、次いでペプチドやタンパク質、核酸、塩類を含むバイオシーケンス(7.7%)となりました(図3左図)。 これは、ペプチドをベースとした初期のタンパク質標的キメラ分子からの変化を示しています。 タンパク質ディグレーダーは多段階の化学反応によって合成されるため、文献解析結果では合成に関わるSPN(合成調剤)とRCT(反応物)の役割が支配的です(図3右側)。 CAS コンテンツコレクションに索引付けされている化合物のうち、非常に多くの数が特許に由来するものになっています。
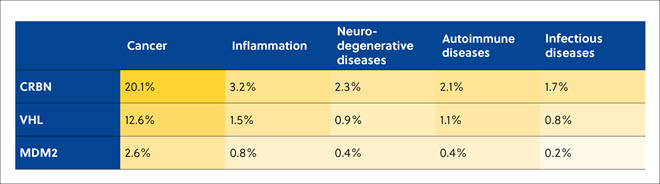
文献解析の結果、がん、炎症、神経変性、自己免疫、そして感染症において、標的タンパク質のユビキチン化とその後のプロテアソーム分解を誘導するためにTPDのリクルートに用いられる最も一般的なタイプのE3リガーゼは、CRBN、VHL、そしてMDM2であることが判明しました(表3)。
表3. CAS コンテンツコレクションにおける、最も広く使われている3種類のE3リガーゼについてのタンパク質ディグレーダー関連の論文件数と対象疾患との相関関係。 パーセンテージは、タンパク質ディグレーダーに関連する論文総数より算出。
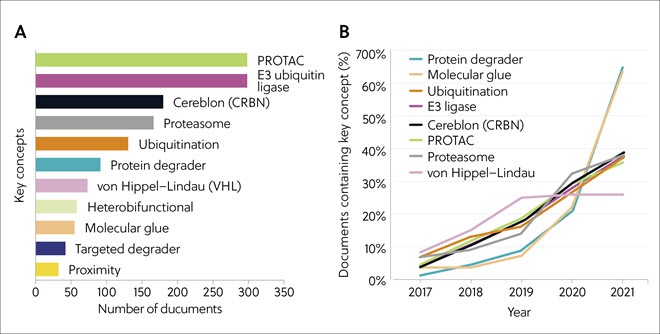
2017年から2021年にかけて最も論文数が多かったのは、PROTACとE3ユビキチンリガーゼで、次いでセレブロン、プロテアソーム、ユビキチン化となっています(図4A)。 分子糊やタンパク質ディグレーダーに関する文献はそれより少なくなるものの、2019年以降は爆発的な増加と関心の伸びを示しています。 ユビキチン化やE3リガーゼ、セレブロン、PROTAC、プロテアソームなどその他の概念も、2017年から2021年の期間を通して継続的に高い伸びを示しています(図4B)。
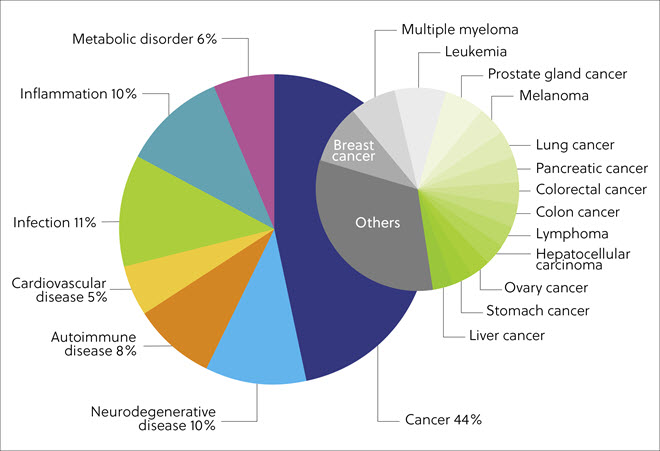
CAS コンテンツコレクションに掲載されているタンパク質ディグレーダーが標的としている疾患を分析したところ、さまざまながん(乳がん、前立腺がん、多発性骨髄腫、白血病など)に関する論文が最も多いことがわかりました(44%)。 さらに、感染症(11%)、神経変性疾患(10%)、炎症性疾患(10%)、自己免疫疾患(8%)、代謝性疾患(6%)、および循環器疾患(5%)も高い比率を示しています(図5)。
分子糊 - 発見と開発の現状
分子糊の既知の種類と構造の数は、すでに相当数になっており、さらに増加しています。 最も広く研究されている分子接着剤は、E3リガーゼCRBNと結合する小分子と、DCAF15と結合するアリールスルホンアミドです。 E3リガーゼ以外のさまざまな作用機序でタンパク質分解を誘導するその他の分子糊としては、オートファジーを介したタンパク質分解、タンパク質間相互作用の安定化、KRAS変異体の阻害、微小管重合の安定化、そしてmTOR(mammalian target of rapamycin)の阻害などがあります。 また、分子糊としての作用があることが分かっている天然化合物として、シクロスポリンAやサングライフリンAなどがあります。 こういった開発は、分子接着剤アプローチの拡大という重要な側面と、より多様な作用範囲の可能性を示しています。
潜在的な分子糊はこれまで多く同定されてきている一方、臨床での治療効果が評価されたものは非常に少なく、規制当局の承認を受けたものはさらに少ないのが現状です。 世界中のさまざまな企業が、さまざまながんや神経変性疾患、炎症性疾患への応用を目指して、一連の分子接着剤製品で前臨床試験を行っています。 これには、以下の企業が含まれます。
- Ranok(中国・杭州) - 候補薬「RNK05047」、固形がんおよびリンパ腫の治療薬として2022年前半に臨床試験を開始
- Monte Rosa Therapeutics(米国マサチューセッツ州ボストン)- GSPT1を標的とした癌治療リードプログラム、およびそれに続く流れでINDに向けた活動を開始。 治験新薬申請は2022年半ばにFDAに提出される予定。 固形腫瘍と液状腫瘍、自己免疫疾患、血液疾患などを標的としたその他の分子接着剤も創薬段階。
- Plexium、Amgenと提携(米国カリフォルニア州サンディエゴ) - 免疫疾患およびがんの治療を目的としたIKZF2を標的とするセレブロン分子接着剤のリード最適化段階
- Frontier Medicines、AbbVieと提携(米国カリフォルニア州サンフランシスコ) - 難治性の免疫およびがんの標的に対する低分子共有結合薬の創薬段階
- f5 Therapeutics(米国カリフォルニア州サンディエゴ) - 複数の異なる癌、多発性硬化症、関節リウマチ、非アルコール性脂肪肝、肝線維症の分子候補薬
- Ambagon Therapeutics、BMSそしてMerckと提携(米国カリフォルニア州サンカルロス) - 5つの早期発見癌治療化合物の創薬段階
- Amphista Therapeutics(英国、ロンドン) - E3リガーゼ以外の作用機序を有するがん治療薬
- Proxygen、Boehringer Ingelheimと提携(オーストリア、ウィーン)- 肺がんおよび消化器がん治療の創薬段階
- Neomorph、Dana Farber Cancer Instituteと提携(米国カリフォルニア州サンディエゴ)- アンドラッガブルな標的に対する分子接着剤開発パイプラインを進展させるための創薬段階
- Seed Therapeutics、Lillyと提携(米国ニューヨーク州ニューヨーク) - がん、神経変性疾患、感染症の治療のための分子接着剤パイプライン候補の創薬段階。 リード化合物の標的は癌遺伝子KRAS
- Pin Therapeutics (韓国、ソウル) - 創薬段階
- Venquis Therapeutics(米国カリフォルニア州サンディエゴ) - がんおよび変性疾患に対する創薬段階
- IRB Barcelona、Almirallと提携(スペイン、バルセロナ)- 皮膚疾患治療のための創薬段階
- Shanghai Dage Biomedical Technology Co., Ltd.(中国、上海)- がん、炎症性疾患、代謝性疾患の標的を対象とする分子糊のパイプライン。 がん分子糊候補のリード最適化段階
- Triana Biomedicines(米国マサチューセッツ州ウォルサム)- 対処が不十分な疾患を治療するために合理的に設計された分子接着剤パイプラインを確立するため2022年4月より開始
- Evotec、BMSと提携(ドイツ・ハンブルグ)- 分子糊ディグレーダーのパイプラインを開発するための創薬段階
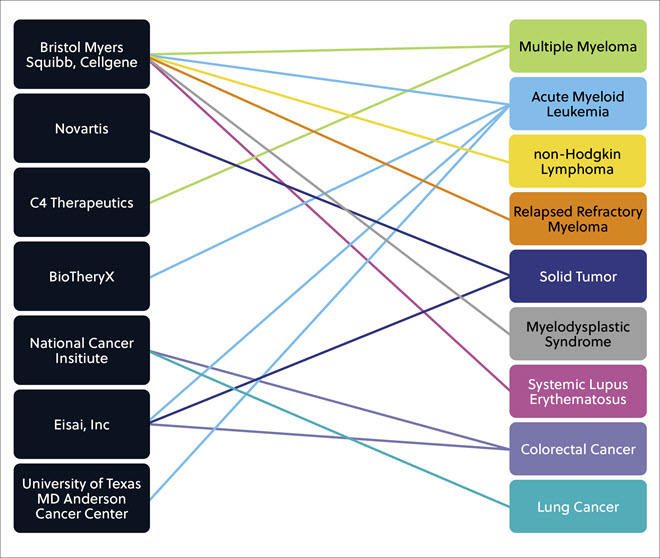
他のいくつかの企業・機関も、全身性エリテマトーデスなどの炎症性疾患や自己免疫疾患とともに、さまざまな固形・液状腫瘍の治療を目的とした、いくつもの有望な分子接着剤化合物が各種臨床開発段階にあります(図6)。
治療薬としての分子糊は、医療のアンメットニーズに応えられるのか
分子糊を用い、通常は接近しない標的タンパク質を分解酵素に接近させる方法は、広範囲にわたる深刻な疾病に対して、非常に新規性の高い治療薬を大量に創出する可能性を秘めた、画期的なアプローチです。 今後は、有用な活性を持つ候補化合物を特定し、臨床的に有用な製品へと進展させることで、TPDアプローチを発展させていくことが課題になります。
分子糊の作用機序や設計原理は十分に解明されていないため、新規化合物を創製し、それを十分に活用するためにはさらなる研究が必要です。 これまで、新規分子糊の探索は、HTS(ハイスループット・スクリーニング)と、それに続く系統的な検証によって行われてきました。 新しく、そしてより効率的な化合物の開発を強化し、さまざまな症状における活性を評価するためには、効率的かつ合理的な設計戦略が求められています。 偶然に頼る方法から合理的な設計に移行するには、分子糊結合をモデル化して予測する計算ツールや、タンパク質結合の理解を深める結晶化での発展が必要になります。
CAS コンテンツコレクションでの検索によれば、分子糊を用いたタンパク質分解の誘導というトピックは、研究論文と特許の両面で広く関心を集め、また爆発的な伸びを示していることがわかります。 E3リガーゼを標的とする化合物が引き続き優勢である一方、非E3リガーゼ化合物やいくつかの天然分子糊のディグレーダーにも強い関心が向けられており、潜在的な薬剤は多様であることが示唆されています。 したがって、分子糊の将来は有望であると思われます。このアプローチを用いた治療薬は、近い将来さらに多く登場することが予想され、医療上のさまざまなアンメットニーズに対応できる有望な可能性を秘めているといえます。
分子糊ディグレーダーの爆発的な増加、その治療への応用、そしてこの10年間で研究分野がどのように進化してきたかについては、弊社CAS Insights Reportをダウンロードしてお読みください。