什么是分子胶?
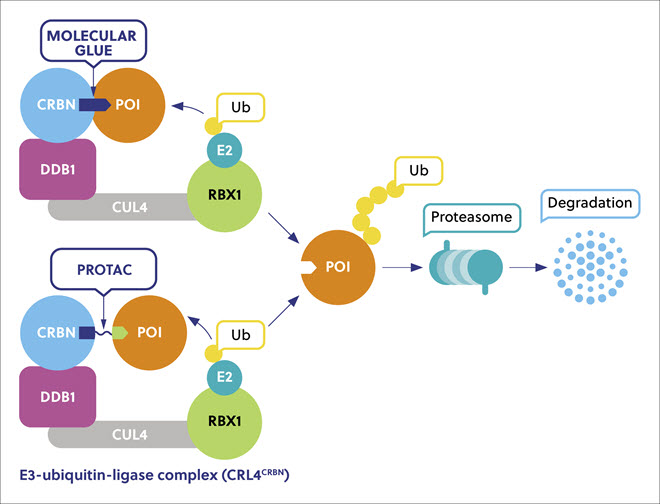
分子胶是一种小型化学实体。它使用一种突破性的策略,即邻近诱导靶蛋白降解 (TPD),TPD中感兴趣的致病蛋白 (POIs) 与天然消化酶连接并被破坏(图 1)。或:分子胶是一类介导了邻近诱导的蛋白质降解 (TPD) 的小分子化合物,在这个过程中,降解剂介导的靶蛋白 (protein of interest, POI) 与天然消化酶链接并被降解(图 1) 这种方法有效地将 POI“粘附”或连接到泛素 - 蛋白酶体系统的 E3 泛素连接酶,该系统通常作为细胞垃圾处理系统。 这种方法创造了全新模式的新型治疗剂,具有令人兴奋的对抗各种严重疾病的潜在活性,如癌症、炎症和免疫疾病以及感染,其中许多疾病是由致病蛋白的异常表达造成的。 在人类基因组中有超过 600 个 E3 泛素连接酶被编码,到目前为止,只有少数使用 TPD 方法被开发,因此有相当大的潜力开发出更多的此类酶。
2022 年 10 月 5 日下午 2 点,Neomorph 公司首席执行官 来自Dana-Farber的专家 和 CAS 专家在 ACS 线上研讨会上探讨了分子胶、靶向蛋白降解和诱导接近的新趋势。 点此注册。
蛋白质降解剂的优势在于它们通过瞬时结合而不是竞争性占据起作用,并在促进 POI 多泛素化后解离。 因此,单个降解剂可以破坏致病蛋白质的许多拷贝,从而在低剂量下高效靶向先前认为的“不可成药”蛋白。 蛋白质抑制剂药物可以阻断致病性蛋白的活性位点,而降解剂则可以去除致病性蛋白的所有功能,从而提高对 POIs 的敏感性,并更好地影响非酶蛋白相互作用。
在过去的二十年中,利用泛素驱动的天然蛋白降解来实现治疗目的的 TPD 化合物的开发取得了长足的进展。 Proteinix 于 1999 年申请了首个将 POI 连接到 E3 连接酶的治疗性嵌合降解剂的专利。 随后进行了一项概念验证研究,其中一种癌症相关蛋白被蛋白降解靶向联合体 (PROTAC) 成功降解。 早期 PROTACs 为大分子结构;2008 年发表了第一篇利用 nutlin-3 招募 MDM2 的小分子雄激素受体 (AR) 降解剂的报告。 随后小分子模拟 HIF1α 肽的发现加速了小分子 PROTACs 的合理设计。 到目前为止,很少有邻近诱导的 TPDs 达到临床测试,但有两种针对雄激素和雌激素受体的 PROTACs(ARV-110 和 ARV-471)已进入临床II期试验,还有许多其他药物正在开发中。
分子胶与 PROTACs 具有不同的特性。 分子胶是一种小分子,它们与各种难以预测的靶蛋白相互作用,通过诱导和增强两种蛋白质的相互作用显示出不同的生物活性,否则两种蛋白质之间不会显示出内在的亲和力。 PROTACs 是由两个部分组成的二价分子,一个与 POI 结合,另一个与 E3 连接酶结合,通过连接子连接。 与 PROTACs 相比,分子胶体积更小,预计具有比 PROTACs 更好的药理学性质、更高的膜通透性、更好的细胞摄取和更好的血脑屏障穿透能力。 分子胶的发现主要依赖于偶然性,但针对无成药性的蛋白质的合理设计方法正在不断出现。 在初步发现后,后续的发现途径还包括继续进行骨架(或核心结构)定义、优化和验证(表 1)。
表 1. 分子胶降解剂的发现途径与结构导向药物设计:
| Initial Discovery | Scaffold Definition |
| Optimization | Validation |
人们发现了各种类型的分子胶;最著名的可能是沙利度胺 (thalidomide) 及其类似物,以及针对 E3 连接酶脑的来那度胺 (lenalidomide) 和泊马度胺 (pomalidomide)。 分子胶已被确定具有多种其他作用机制,包括自噬介导的蛋白降解、MEK 亚复合物稳定、KRAS 突变体抑制、α-微管蛋白聚合稳定和 FK 506 结合蛋白 12 (FKBP12) 降解。
分子胶研究概况-如 CAS 内容合集 (CAS Content Collection™) 所示
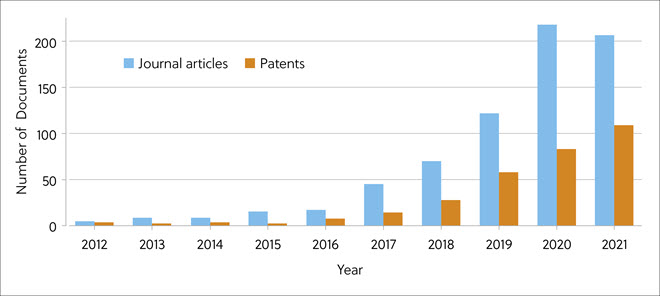
CAS 内容合集™ 是全球最大的利用科学家人工标引的已发表科学信息内容合集,适用于对全球科学出版物进行定量分析,如:发表时间、研究领域、配方、应用以及化学成分等。 为了评估分子胶研究的最新进展,尤其是在药物化学和药物发现方面,一份新的 CAS 洞察报告分析了 2012 至2021 年间 CAS 内容合集中发表的相关数据。 在此期间发表的与蛋白质降解剂剂相关的文章和专利数量呈爆炸式增长(图 2)。
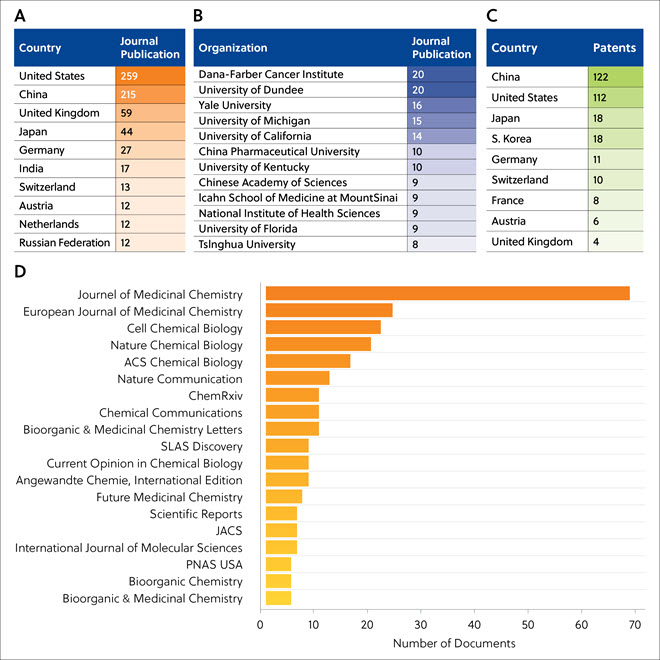
关于蛋白质降解剂的期刊出版物主要来自美国、中国、英国、日本、德国等(表 2A)。 丹娜—法伯癌症研究所 (Dana-Farber) 和邓迪大学 (Dundee) 发表了最多的 TPD 相关期刊文章(表 2B)。 中国和美国的蛋白降解物相关专利申请数量最多(表 2C)。 表 2D 列出了经常发表 TPD 相关文章的期刊,突出了 TPD 在医学研究中的重要性;《药物化学杂志》(Journal of Medicinal Chemistry) 和《欧洲药物化学杂志》(European Journal of Medicinal Chemistry) 的发表 TPD 相关文章最多。
表 2. 发表 TPD 相关期刊文章的主要国家 (A)、组织 (B) 和科学期刊 (D),申请 TPD 相关专利的主要国家 (C)。
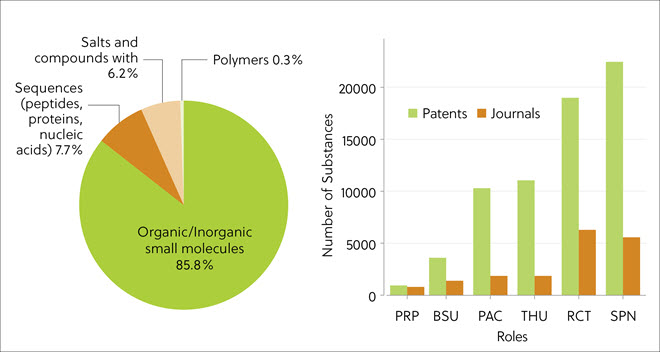
在出版物中,最常见的 TPD 类型是小分子 (85.8%),其次是生物序列 (7.7%),包括多肽、蛋白质、核酸和盐(图 3 左)。 这表明早期基于肽的蛋白质靶向嵌合分子发生了变化。 蛋白质降解剂是通过多步化学反应合成的,这解释了在文献分析结果中为何 SPN(合成制备)和 RCT(反应物)的物质量占多数的原因(图 3,右图)。 CAS 内容合集从专利中标引了大量化合物。
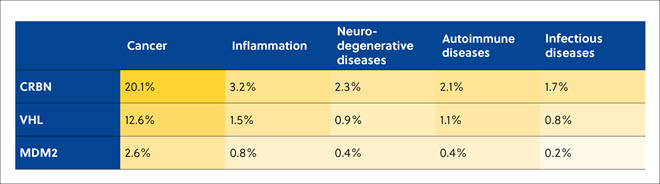
在文献分析中发现,CRBN、VHL 和 MDM2 是最常用的 E3 连接酶类型,用于招募 TPDs,以诱导泛素化以及随后的靶蛋白在癌症,炎症,神经退行性,自身免疫性和传染病中的蛋白酶体降解(表 3)。
表 3. CAS 内容合集中三种使用最为广泛的 E3 连接酶的蛋白质降解剂相关出版物数量与靶向疾病的相关性。 表中百分比由这三种蛋白质降解剂相关出版物数量除以与蛋白质降解剂相关出版物总数计算得出。
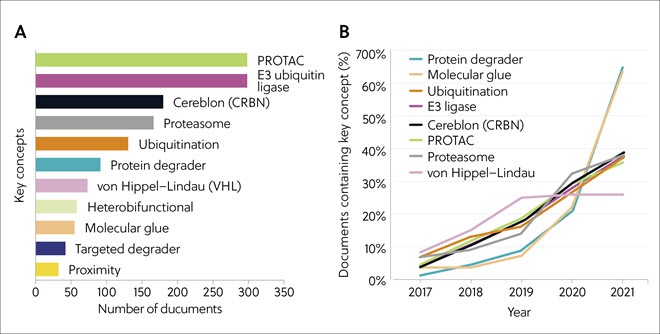
2017-2021 年间,关于 PROTACs 和 E3 泛素连接酶的出版物数量最多,其次是脑蛋白酶 (Cereblon)、蛋白酶体和泛素化(图 4A)。 关于分子胶和蛋白质降解剂的文献数量较少,但从 2019 年开始呈现文献量和研究兴趣呈爆炸性增长。 其他概念词包括泛素化、E3 连接酶、脑蛋白酶、PROTAC 和蛋白酶体,也在 2017-2021 年间持续强劲增长(图 4B)。
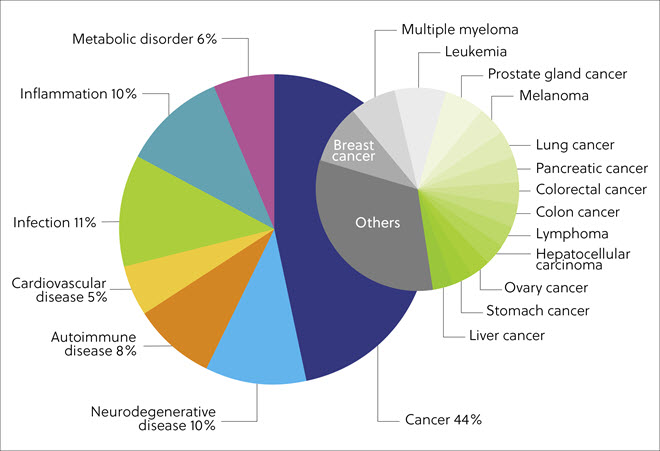
对 CAS 内容合集中蛋白质降解剂靶向疾病的分析显示,大部分 (44%) 的出版物与各种癌症(如乳腺癌和前列腺癌、多发性骨髓瘤和白血病)相关。 此外,感染性疾病 (11%)、神经退行性疾病 (10%)、炎症性疾病 (10%)、自身免疫性疾病 (8%)、代谢性疾病 (6%) 和心血管疾病 (5%) 的比例也很高(图 5)。
分子胶——已发现的和正在发展的
文献分析已知的分子胶类型和结构的数量已经相当可观,而且还在增长。 研究最为广泛的分子胶是结合 E3 连接酶 CRBN 的小分子和结合 DCAF15 的芳基磺酰胺。 其他通过各种非 E3 连接酶作用机制诱导蛋白质降解的分子胶包括自噬介导的蛋白质降解、蛋白质-蛋白质相互作用稳定化、KRAS 突变体抑制、微管聚合稳定化和雷帕霉素哺乳动物靶标 (mTOR) 抑制。 此外,研究还发现许多天然化合物(如环孢菌素 A 和萨菲菌素 A)可用作分子胶。 这些研究进展表明分子胶方法得到了极大扩展,可能具有更广泛的作用范围。
虽然已经确定了许多分子胶,但迄今为止,只有少数几种的临床疗效经过评估,获得监管部门批准的就更少了。 全球多家公司都有一系列分子胶产品处于临床前开发阶段,以用于治疗各种癌症、神经退行性疾病和炎症。 这些公司的简介如下:
- 珃诺生物 (Ranok,中国杭州) — 候选药物 RNK05047 于 2022 年上半年进入临床试验,用于治疗实体瘤和淋巴瘤
- Monte Rosa Therapeutics(美国马萨诸塞州波士顿)— 为其靶向 GSPT1 治疗肿瘤及其他疾病的主要项目开展了一系列活动以通过新药研究申请 (IND)。 IND 申请将于 2022 年年中提交给 FDA。 其他靶向实体瘤/液体瘤、自身免疫病和血液疾病的分子胶仍处于药物发现阶段
- Plexium/与 Amgen 合作项目(美国加利福尼亚州圣地亚哥)— 用于治疗免疫疾病和癌症的靶向 IKZF2 的 cereblon 分子胶处于先导化合物优化阶段
- Frontier Medicines/与 AbbVie 合作项目(美国加利福尼亚州旧金山)— 靶向难治免疫和肿瘤靶点的小分子共价药物处于药物发现阶段
- f5 Therapeutics(美国加利福尼亚州圣地亚哥)— 有针对多种不同癌症、多发性硬化症、类风湿性关节炎、非酒精性脂肪性肝炎和肝纤维化治疗的候选分子
- Ambagon Therapeutics/与百时美施贵宝和默克合作项目(美国加利福尼亚州圣卡洛斯)— 五种早期发现的肿瘤治疗化合物处于药物发现阶段
- Amphista Therapeutics(英国伦敦)— 具有非 E3 连接酶作用模式的癌症治疗
- Proxygen/与 Boehringer Ingelheim 合作项目(奥地利维也纳)— 药物发现阶段,旨在治疗肺癌和胃肠道癌症
- Neomorph/与 Dana Farber 癌症研究所合作项目(美国加利福尼亚州圣地亚哥)— 药物发现阶段,以推进其针对不可成药靶点的分子胶开发流程
- Seed Therapeutics/与 Lilly 合作项目(美国纽约州纽约)— 药物发现阶段,具有分子胶候选开发流程,旨在治疗癌症、神经退行性疾病和传染病。 他们的先导化合物靶向 KRAS 癌基因
- Pin Therapeutics(韩国首尔)— 药物发现阶段
- Venquis Therapeutics(美国加利福尼亚州圣地亚哥)— 药物发现阶段,旨在治疗癌症和退行性疾病
- IRB Barcelona/与 Almirall 合作项目(西班牙巴塞罗那)— 药物发现阶段,旨在治疗皮肤病
- 上海达哥生物科技有限公司 (中国上海)— 靶向癌症、炎症性疾病和代谢性疾病靶点的分子胶处于开发流程。 候选肿瘤分子胶处于先导化合物优化阶段
- Triana Biomedicines(美国马萨诸塞州沃尔瑟姆)— 最近于 2022 年 4 月开始研究,旨在建立设计合理的分子胶开发流程,以治疗未充分解决的疾病
- Evotec/与 BMS 合作项目(德国汉堡)— 药物发现阶段,以推进分子胶降解剂开发流程
其他几家公司/机构也有一系列分子胶化合物处于临床开发的各个阶段,前景光明,旨在治疗多种不同的实体瘤和液体瘤以及炎症和自身免疫病,如系统性红斑狼疮(图 6)。
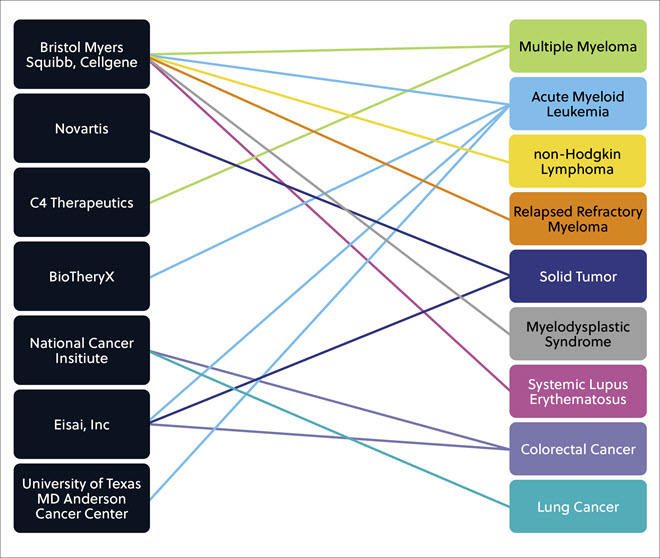
分子胶用作治疗药物的前景 — 能否解决未得到满足的医疗需求?
利用分子胶诱导靶向蛋白接近降解酶(否则不会发生紧密接触)的方法十分令人兴奋,有可能创造出大量高度新颖的治疗药物,实现多种严重疾病的治疗。 难点在于现在要通过识别具有有用活性的候选化合物并将其发展为临床可用产品来开发 TPD 方法。
分子胶的作用机制及其设计原理尚不清楚,需要进一步研究,以创造出新型化合物并加以充分利用。 新型分子胶的发现方法很大程度上依赖于大量高通量筛选以及系统验证工作。 还需要高效、合理的设计策略来促进更有效的新型化合物开发,并评估其在不同适应症中的活性。 要从偶然发现发展为合理设计,我们需要能够模拟和预测分子胶结合的计算工具以及结晶方面的进步,从而增进对蛋白质对接的理解。
CAS 内容合集检索结果表明,利用分子胶诱导蛋白质降解引起了广泛研究兴趣,相关研究文章和专利出现爆发性增长。 虽然 E3 连接酶靶向化合物仍占据主导地位,但非 E3 连接酶化合物和一些天然分子胶降解剂也备受关注,这表明存在多种潜在试剂。 在不久的将来,可能会出现更多使用这种方法的治疗药物,有望解决多种未得到满足的医学需求,因此分子胶的前景十分光明。
下载我们的 CAS 洞察报告,了解分子胶降解剂的爆发性增长及其治疗应用,以及相关研究在过去十年中的演变过程。