Gain new perspectives for faster progress directly to your inbox.
A Organização Mundial da Saúde (OMS) define um microrganismo que não é morto/inativado após o devido tratamento como “resistente”, e o aumento de organismos resistentes é multifatorial. Segundo os Centros de Controle e Prevenção de Doenças (CDC), ocorrem anualmente mais de 2,8 milhões de infecções bacterianas resistentes a antibióticos, resultando em mais de 35.000 mortes. O mais preocupante é que as projeções feitas pelo Banco Mundial estimam que esse número poderá aumentar para 10 milhões de mortes por ano até 2050.
Sendo assim, a OMS declarou a resistência antimicrobiana como uma das dez principais preocupações de saúde, e são necessárias novas soluções com urgência.
A resistência aos antibióticos é multifatorial
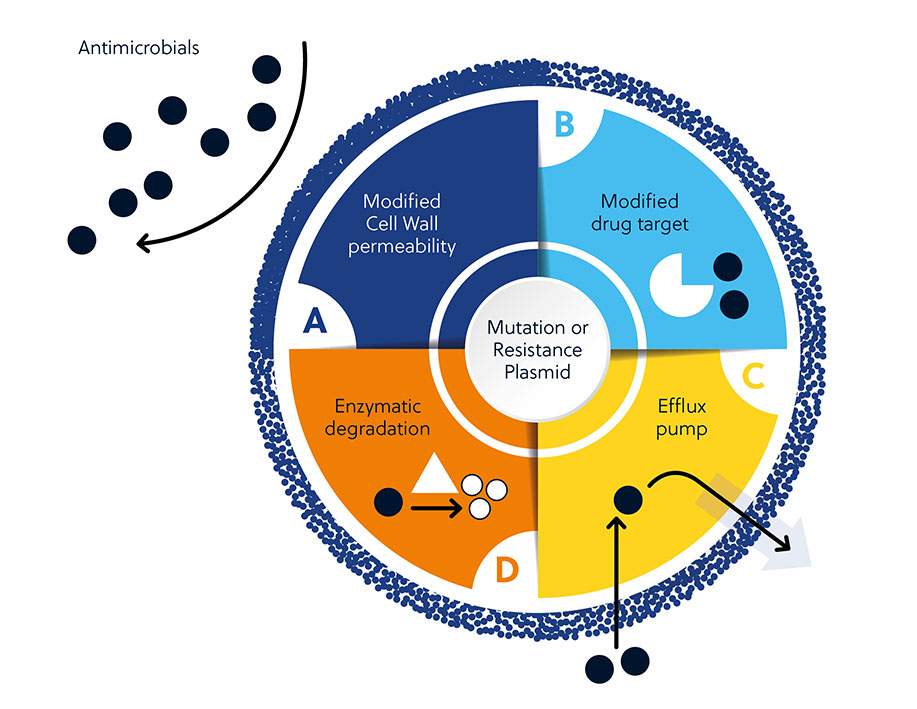
A resistência aos antibióticos é resultado de fatores intrínsecos e adquiridos. Dentre os fatores intrínsecos estão a permeabilidade da parede celular, alvos de medicamentos modificados, ativação de bombas de efluxo e degradação enzimática dos antibióticos. Já a resistência adquirida tem origem no ganho de novo material genético ou em mutações do genoma bacteriano que atua como um agente intermediário da sobrevivência.
A necessidade de novos tratamentos antibacterianos
Os antibióticos abrangem muitas classes diferentes. Cada um é categorizado pela estrutura e por como ele combate as bactérias no corpo.
| Classe de antibiótico | Estrutura |
| Aminoglicosídeos (por ex., estreptomicina, 57-92-1) | |
| Beta-lactâmicos (por ex., penicilina, 61-33-6) | 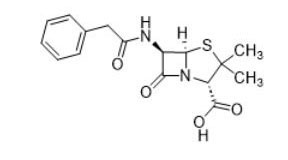 |
| Sulfonamidas (por ex., sulfadiazina, 68-35-9) | 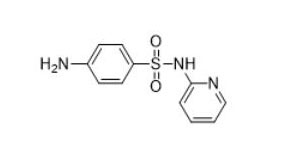 |
| Anfenicois (por ex., cloranfenicol, 56-75-7) | |
| Polimixinas (por ex., polimixina B, 1404-26-8) | |
| Tetraciclinas (por ex., tetraciclina, 60-54-8) | |
| Macrolídeos (por ex., claritromicina, 81103-11-9) | |
| Pirimidinas (por ex., sulfadiazina, 68-35-9) | 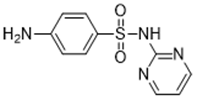 |
| Rifamicinas (por ex., rifampicina, 13292-46-1) | |
| Quinolonas e fluoroquinolonas (por ex., ácido nalidíxico, 389-08-2) | |
| Estreptograminas (por ex., quinupristina, 120138-50-3) | |
| Lincosamidas (por ex., lincomicina, 154-21-2) | |
| Pleuromutilinas (por ex., lefamulina, 1061337-51-6) | |
| Oxazolidinonas (por ex., linezolida, 165800-03-3) |
Tabela 1. As diferentes classes de antibióticos.
Apesar dessas opções de tratamento já estabelecidas, muitas infecções estão se tornando resistentes aos tratamentos antibióticos existentes. Associado a um aumento estimado nas mortes relacionadas, há uma necessidade premente de repensar a forma de combatermos as infecções bacterianas.
Os desafios enfrentados pelos novos antimicrobianos
Embora o aumento da resistência antimicrobiana seja multifacetado, ele é agravado pelo ritmo mais lento de desenvolvimento de novas opções de tratamento em comparação com a taxa de desenvolvimento de resistência antimicrobiana.
Isso é evidenciado quando se olha para o número de publicações em revistas sobre resistência antimicrobiana versus a baixa proporção de patentes (Figura 2). Isso indica que os pesquisadores acadêmicos estão assumindo um papel mais proeminente no desenvolvimento de novos antimicrobianos — e que esses esforços devem ser traduzidos em terapias comercialmente disponíveis.
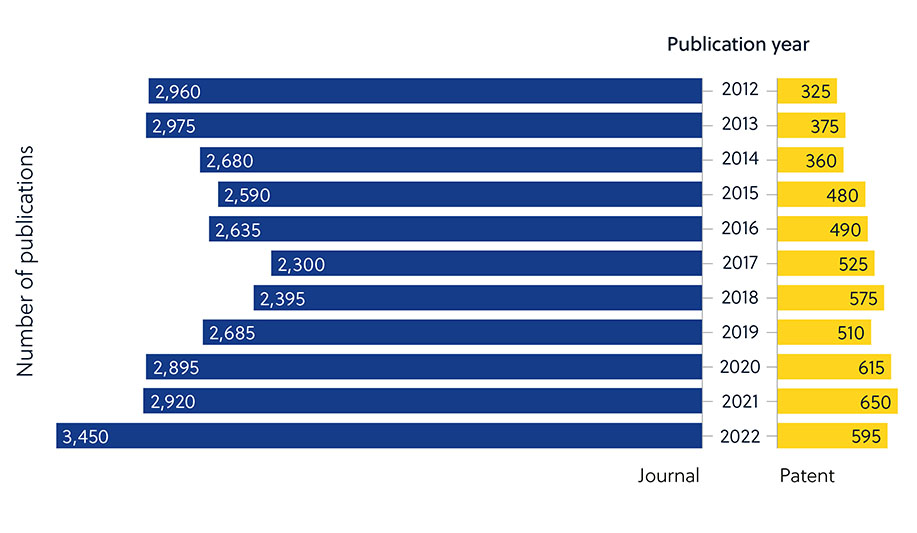
Isso pode ser explicado por vários fatores que tornam o desenvolvimento de antimicrobianos tão desafiador. Além de muitos mecanismos inatos ou adquiridos que os micróbios podem utilizar para resistir aos antimicrobianos (Figura 1), existem também fatores mais amplos que dificultam o desenvolvimento (Figura 3).
A capacidade de as bactérias tolerarem antimicrobianos, combinada com o elevado custo de desenvolvimento e os longos prazos (Figura 3), fez com que poucos antibióticos chegassem ao mercado nas últimas décadas, apesar da necessidade extrema.
Biofilmes
O crescimento em um biofilme, ou camada de células, permite que as bactérias resistam à penetração de antibióticos. Os biofilmes podem crescer em cateteres, marca-passos, próteses articulares, dentaduras, lentes de contato, próteses de válvulas cardíacas e implantes. O crescimento em um biofilme, ou camada de células, permite que as bactérias resistam à penetração de antibióticos. Os biofilmes podem crescer em cateteres, marca-passos, próteses articulares, dentaduras, lentes de contato, próteses de válvulas cardíacas e implantes.
Camada externa de bactérias Gram-negativas
As bactérias Gram-negativas são naturalmente resistentes a vários medicamentos que afetam as espécies Gram-positivas devido à sua membrana externa, uma camada dupla e impenetrável para muitos medicamentos.
Retorno sobre o investimento
A baixa taxa de sucesso de moléculas candidatas em combinação com o menor retorno sobre o investimento são os maiores desafios.
Cronogramas
Leva de 10 a 15 anos entre a descoberta inicial da molécula e a chegada de um antibiótico viável ao mercado.
Figura 3. Fatores que podem atrapalhar o desenvolvimento de antimicrobianos.
Alternativas aos antibióticos convencionais
Colocar novos antibióticos no mercado é um desafio demorado (Figura 3), portanto as alternativas ajudam a combater a resistência antimicrobiana.
| Inibição rigorosa da resposta | A sobrevivência a longo prazo das bactérias no hospedeiro, muitas vezes de forma assintomática, pode levar à reativação e reinfecção. Essas bactérias de longa sobrevivência são chamadas de “bactérias persistentes”. A resposta rigorosa é um mecanismo pelo qual as bactérias enfrentam a fome extrema, que se acredita contribuir para o desenvolvimento de infecções persistentes. A inibição desse processo pode tornar as bactérias mais suscetíveis aos antibióticos. |
| Vacinas bacterianas | A prevenção de infecções bacterianas com vacinas levará à diminuição do consumo de antibióticos e provavelmente ajudará no combate à resistência aos antibióticos. Um relatório da OMS de 2021 forneceu detalhes sobre mais de 60 e mais de 90 vacinas em desenvolvimento clínico e pré-clínico, respectivamente. |
| Peptídeos antimicrobianos | Os peptídeos antimicrobianos vêm ganhando popularidade como alternativas aos antibióticos de moléculas pequenas. São tipicamente peptídeos curtos (menos de 100 aminoácidos) com um amplo espectro de atividade antimicrobiana. Segundo o banco de dados de peptídeos antimicrobianos, havia mais de 3.000 peptídeos antimicrobianos em novembro de 2022. |
| Glicopeptídeos | Os glicopeptídeos apresentam atividade antibacteriana principalmente contra bactérias Gram-positivas, inibindo a biossíntese da parede celular. Os medicamentos geralmente usados nesse grupo são vancomicina, teicoplanina, telavancina, dalbavancina e oritavancina, mas diversas opções novas estão em desenvolvimento, em estudo ou sendo otimizadas. |
| Lipopeptídeos e lipoglicopeptídeos | A daptomicina é o único lipopeptídeo atualmente usado contra bactérias Gram-positivas e funciona rompendo a membrana celular bacteriana. O efeito antibacteriano observado parece depender da presença e da ligação com o cálcio. Por terem um tamanho grande, são pouco absorvidos quando tomados por via oral e tendem a ser administrados por via intravenosa. |
| Bacteriófagos | Bacteriófagos são vírus capazes de infectar células bacterianas e matá-las por meio de injeção de DNA viral. O vírus se replica no interior da célula e causa lise celular à medida que as réplicas são liberadas para encontrar uma nova célula bacteriana para infectar. No entanto, ainda devem ser enfrentados desafios para tornar a terapia com bacteriófagos mais viável, incluindo a fraca eficácia in vivo para atingir espécies bacterianas no intestino após administração oral. |
Tabela 2. Alternativas aos antibióticos convencionais
O futuro dos antimicrobianos
O aprimoramento dos métodos de administração de medicamentos por meio de materiais pode fornecer atividade antibacteriana localizada, prolongada e dependente de estímulo. Existem várias maneiras de realizar a administração de antimicrobianos além da administração tradicional. Dispositivos médicos como implantes e cateteres podem ser fontes de infecção, que podem ser potencialmente prevenidas com o uso de materiais antimicrobianos. Da mesma forma, os revestimentos antimicrobianos em superfícies de tráfego intenso podem reduzir a transmissão de micróbios e minimizar a necessidade de limpeza.
Hidrogéis
Usados em associação a antibióticos para administrar medicamentos e cicatrizar de feridas. Os hidrogéis atuam in situ enquanto são expostos a células e fluidos corporais para permitir a administração de agentes antibióticos difusíveis ou ligados a um gel, como peptídeos antimicrobianos.
Nanopartículas
O tamanho pequeno das nanopartículas facilita a administração eficaz de medicamentos. A modificação da superfície pode ser usada para adaptá-las a alvos e locais específicos, e a química de superfície e a composição controlam o tempo de atividade, a liberação do medicamento e a duração da ação.
Compósitos
Os compósitos usam vários materiais juntos e são usados em dispositivos médicos, como implantes dentários. Diversos materiais capazes de exercer atividade antimicrobiana têm se comprovado eficazes, tanto no tratamento quanto na prevenção de infecções e transmissões.
Filmes ou revestimentos
Reduzir a capacidade dos dispositivos médicos de transmitir infecções seria uma forma eficaz de melhorar a saúde e a sobrevivência dos pacientes em hospitais. A capacidade de aproveitar a luz UV, ou luz visível, e gerar espécies reativas de oxigênio que impedem a adesão de micro-organismos são dois exemplos de filmes e revestimentos eficazes.
Andaimes e implantes
Úteis para cicatrização de feridas e ossos, eles normalmente têm uma relação alta entre área de superfície e o volume, e são mais persistentes que os hidrogéis. Implantes com polímeros catiônicos, nanopartículas de cobre ou agentes liberadores de óxido nítrico têm demonstrado eficácia promissora.
Figura 4. Materiais e soluções que podem reduzir o uso de antibióticos
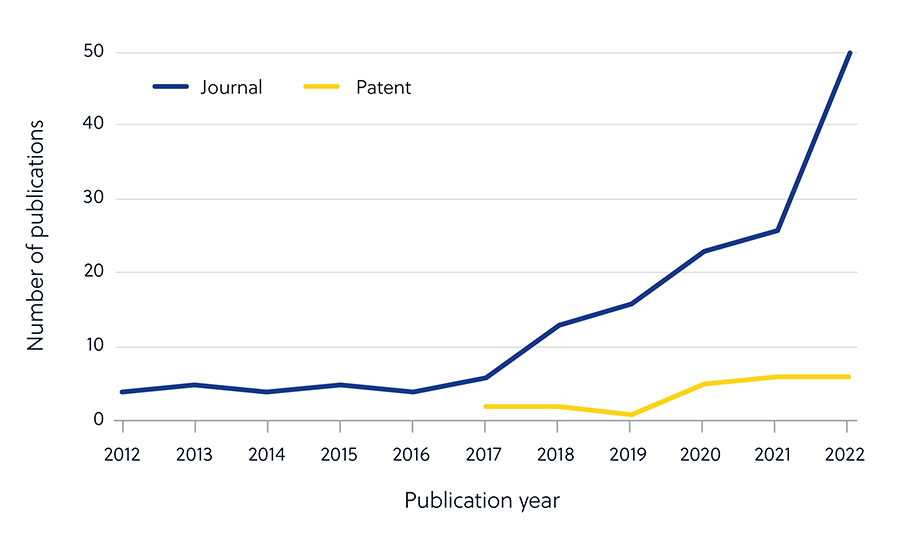
Os avanços na inteligência artificial (IA) levaram a uma aceleração no desenvolvimento de medicamentos antimicrobianos usando algoritmos para identificar potenciais novas moléculas. Embora o número de publicações em revistas tenha aumentado constantemente, não houve um aumento correspondente nos pedidos de patentes, sugerindo que a maioria das pesquisas antimicrobianas com IA ainda se encontra na fase acadêmica (Figura 5).
O aumento de bactérias multirresistentes representa uma ameaça alarmante para a saúde humana, e a necessidade de desenvolver novos antibióticos e materiais antibacterianos é urgente. O uso generalizado da IA ainda está dando os primeiros passos. No entanto, é promissor para simplificar e reduzir os prazos para esforços futuros. Saiba mais sobre o impacto da IA na química em nosso Relatório de Insights, a ascensão dos grandes modelos de linguagem e como biomateriais estão sendo usados em todo o cenário terapêutico em uma variedade de novas abordagens.