Protéines RAS : une cible évasive ?
Environ un cancer humain sur cinq présente au moins une forme de mutation de RAS (K-RAS, H-RAS et N-RAS), ce qui fait de RAS la famille de gènes la plus fréquemment mutée dans les cancers humains. Les protéines RAS, situées sur la membrane du plasma cellulaire, agissent comme des interrupteurs moléculaires qui envoient des signaux de croissance cellulaire. Toutefois, les mutations des protéines RAS pourraient les rendre actives constamment et envoyer des signaux de croissance incontrôlables, entraînant une prolifération anormale des cellules et la formation de cancers.
Malgré leur prolifération, il y a un manque très net de traitements ciblant ces protéines RAS. Les inhibiteurs de RAS font l'objet de recherches dans le traitement du cancer depuis plus de trois décennies. Pourtant, les protéines RAS passent pour être « non médicamentables » en raison de leur potentiel inhibiteur évasif, du moins, jusqu'à une époque récente. Il y a quelques mois, la FDA a approuvé le sotorasib (développé par Amgen et portant le nom commercial de Lumakras™) pour le traitement du cancer du poumon, le premier inhibiteur de RAS approuvé comme traitement.
L'approbation du sotorasib constitue un progrès majeur dans l'inhibition du RAS, et les efforts de recherche et de développement pour découvrir d'autres inhibiteurs de RAS se sont intensifiés. Nous explorons ici la manière dont le fossé est en train de se combler en ce qui concerne les protéines RAS : autrefois considérées comme des cibles évasives et non médicamentables, elles apparaissent aujourd'hui comme un traitement prometteur contre le cancer.
K-RAS : la mutation la plus courante des gènes RAS
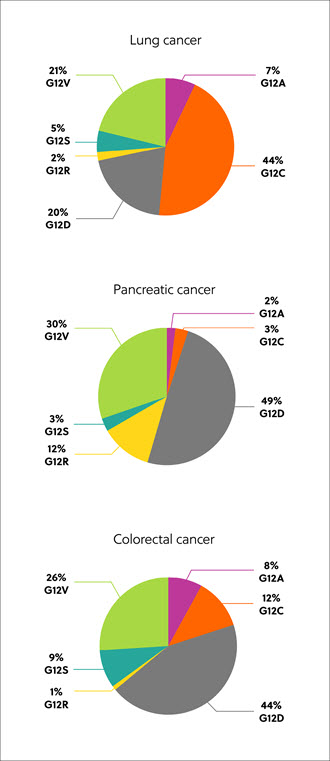
Les gènes RAS codent les protéines, qui existent dans quatre isoformes : K-RAS4A, K-RAS4B, N-RAS et H-RAS. Les isoformes RAS mutantes, le codon et la substitution des acides aminés varient selon les tissus et le type de cancer, mais les plus courantes sont des mutations de l'isoforme K-RAS, présentes dans environ 22 % des cancers avec mutation de RAS. 80 % des mutations K-RAS se produisent à la position 12 des acides aminés, de la glycine vers d'autres résidus, notamment la cystéine (G12C, 14 %), l'acide aspartique, (G12D, 36 %) et la valine (G12V, 23 %) (Figure 1).1
Découverte des protéines RAS comme candidates pour le traitement du cancer
Les inhibiteurs de RAS sont identifiables par radiocristallographie À l'aide de cette méthode, les structures des protéines RAS peuvent être examinées pour identifier des poches de liaison potentielles à occuper par des petites molécules dans les cellules cancéreuses humaines. Ce type d'approche - conception de médicaments basés sur les structures - permet de découvrir des centaines de substances chimiques susceptibles de se lier à l'intérieur de poches spécifiques. Les inhibiteurs de RAS potentiels se composent généralement d'une structure en échafaudage légèrement modifiée avec un certain nombre de groupes fonctionnels pour renforcer l'activité, la sélectivité et diminuer la toxicité. Cela produit des composés principaux qui peuvent être davantage analysés, améliorés et testés dans l'espoir de les évaluer dans les essais cliniques sur les cancers humains.
Pour mieux comprendre le paysage actuel des inhibiteurs de RAS, nous avons passé en revue les brevets et les publications liés aux inhibiteurs de RAS dans la collection de contenus CAS™. Cette analyse a révélé 26 958 substances chimiques ayant des rôles thérapeutiques ou pharmacologiques dans l'espace direct des inhibiteurs de RAS. Le nombre de substances chimiques et de brevets présents dans cet espace a augmenté chaque année, soulignant la manière dont les intérêts et les efforts de recherche d'inhibiteurs de RAS gagnent du terrain (Figure 2).
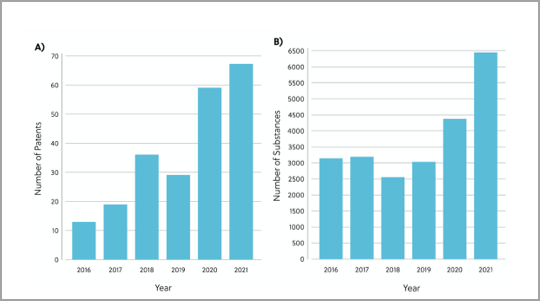
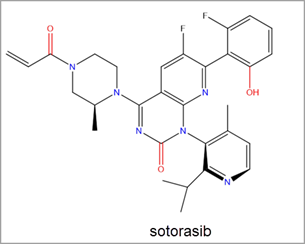
L'approbation récente par la FDA du sotorasib d'Amgen a abouti à une augmentation très nette des efforts de recherche en direction de la découverte d'inhibiteurs de RAS. Le sotorasib est un inhibiteur covalent du KRAS G12C via la poche Switch-II. C'est le premier inhibiteur de KRAS à être approuvé pour une utilisation dans le traitement des cancers humains et pour traiter le cancer du poumon non à petites cellules muté KRAS G12C (NSCLC) (Figure 3).2
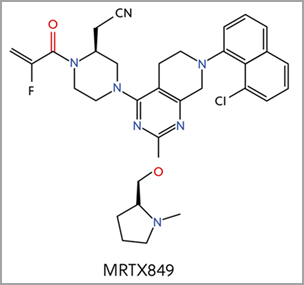
Quatre autres inhibiteurs de KRAS-G12C font actuellement l'objet d'essais cliniques, notamment le MRTX849, basé sur une structure centrale similaire au sotorasib (Figure 4)2 Différents groupes fonctionnels ont abouti à différents mécanismes de liaison pour des éléments clés de la poche Switch II. MRTX849 a obtenu la désignation de traitement innovant par la FDA pour le NSCLC positif au KRAS G12C en juin 2021.
Le voyage continue : développement de l'ampleur des cibles d'inhibiteurs de RAS directs
À mesure que de nouvelles molécules de liaison de RAS sont découvertes, de nouvelles surfaces sur les isoformes de RAS et les protéines RAS sont identifiées comme des cibles potentielles pour les petites molécules.
Dans la mesure où les isoformes de RAS muté, le codon et la substitution d'acides aminés varient selon les tissus et les types de cancer, différentes approches sont nécessaires à partir des inhibiteurs de G12C actuels pour augmenter la portée des traitements du cancer. Les opportunités futures comprennent le développement des types d'acides aminés qui peuvent être ciblés par des inhibiteurs, comme les G12D et G12V, ce qui pourrait élargir les types de cancer que nous sommes en mesure de traiter.
La passerelle est maintenant ouverte pour l'inhibition de RAS et en obtenant une meilleure compréhension de la structure des oncoprotéines RAS et la configuration d'une poche de liaison pour les cibles à petites molécules, il sera possible de développer et d'améliorer de nouveaux inhibiteurs de RAS pour une activité optimale dans les cancers à mutation de RAS.
Lisez notre livre blanc pour en savoir plus sur la suite du parcours de découverte des cibles de RAS et pour avoir notamment un aperçu plus détaillé du paysage actuel des inhibiteurs de RAS dans les structures chimiques et des opportunités futures.
Références
1. H. Chen et al., Small-molecule inhibitors directly targeting KRAS as anticancer therapeutics. J. Med. Chem. 63 (2020) 11404–14424. doi: 10.1021/acs.jmedchem.0c01312.
2. L. Goebel et al., KRASG12C inhibitors in clinical trials: a short historical perspective. RSC. Med. Chem. 11 (2020) 760. doi: 10.1039/d0md00096e.