Gain new perspectives for faster progress directly to your inbox.

Aujourd'hui, les gènes RAS et les oncogènes liés sont utilisés contre plus de 30 % des cancers dans le monde, notamment les cancers du pancréas, du poumon et colorectal. Dans le passé, ces cibles étaient considérées comme non traitables en raison de leurs sites de liaison très peu profonds, de leur emplacement difficile et de leur faible activité enzymatique. Un exemple particulièrement évident d'inhibiteur covalent est le sotorasib (LUMAKRAS®), récemment approuvé par la FDA et qui fait partie d'une catégorie montante d'inhibiteurs de RAS dont les projections de vente en 2024 dépassent 1 milliard de dollars.
Les inhibiteurs covalents ciblés utilisent un système de guidage et une « charge explosive » (figure 1) qui s'est avérée plus facile à lier, plus ciblée et avec moins d'effets secondaires. Avant 2000, de nombreux médicaments qui formaient un lien covalent avec des cibles le faisaient de manière non sélective, ce qui entraînait fréquemment des effets indésirables. On en a alors déduit que les inhibiteurs covalents n'étaient pas des candidats médicaments idéaux, ce qui a abouti à un développement limité dans l'industrie pharmaceutique. Toutefois, les médicaments covalents ont connu une résurgence remarquable au cours des dernières années, comme en témoigne le nombre croissant d'approbations par la FDA aux États-Unis, avec huit médicaments approuvés au cours des dix dernières années pour le traitement du lymphome, du cancer du poumon et du cancer du sein.
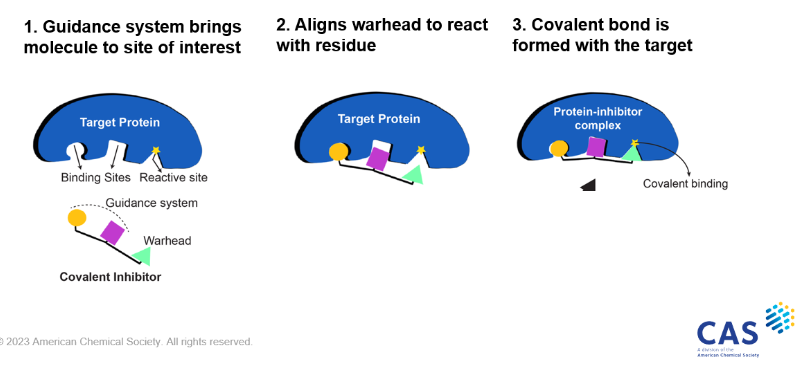
Aujourd'hui, les scientifiques ont conçu des « charges explosives » aux fonctionnalités remarquables, qui démontrent une réactivité très affinée et ne forment des liens covalents que lorsqu'ils sont positionnés au niveau de la cible souhaitée. Des experts de Totus Medicines et de CAS se sont récemment réunis pour organiser un webinaire le 19 octobre 2023.
Découvrez les derniers développements dans le domaine des inhibiteurs covalents ciblés et leurs utilisations contre des cibles jusqu'alors considérées comme non médicamentables. Approfondissez vos connaissances du paysage des inhibiteurs covalents dans notre article CAS basé sur notre récente publication dans ChemRxiv.
Points saillants du webinaire

Pour planter le décor de cette discussion, le Dr Gary Gustafson a présenté un tour d'horizon de ce domaine émergent de la science. Alors que les publications et les tendances de la PI indiquent une accélération des progrès dans la recherche sur les inhibiteurs covalents ciblés, on comprend mieux aujourd'hui leur véritable potentiel. Une plongée plus approfondie dans le paysage des inhibiteurs covalents a révélé les éléments de connaissance et les tendances concernant les « charges explosives » les plus fréquemment utilisées, les protéines qu'ils ciblent et les indications qu'ils traitent.

Le Dr Neil Dhawan a complété cette présentation en expliquant comment les médicaments covalents créent des liens précis qui offrent des options de traitement contre une grande diversité de maladies. Il a présenté la dernière recherche menée par Totus sur les bioactivités du PI3Kα et sur le TOS-358, une molécule qui permet une inhibition complète et hautement spécifique du PI3Kα. Pour terminer, il a évoqué l'approche clinique de la progression du TOS-358 vers une approbation accélérée pour le traitement de multiples tumeurs avec mutation du PI3Kα.
En conclusion, les participants ont posé de nombreuses questions, des origines possibles de la résurgence de la recherche sur les médicaments covalents aux nouvelles technologies fascinantes utilisées dans la recherche de médicaments covalents. En bref, ce débat passionnant a mis en lumière les opportunités prometteuses des inhibiteurs covalents ciblés, de la manière dont ils traitent le cancer et plus encore.
Regardez l'enregistrement et les diapositives associées provenant du webinaire ici.