新しい視点を獲得して、受信トレイに直接送信することで、より迅速に作業を進めることができます。
mRNAワクチンのサクセスストーリー
メッセンジャーRNA(mRNA)ワクチンは多くの人に馴染みのあるコンセプトになりました。これは、mRNAワクチンがCOVID-19パンデミックの経過を大きく変え、数百万人の死亡を防ぐ役割を果たしたからです。 しかし、これは決して新たな発見だったわけではありません。 実際、mRNAの治療薬としての可能性は、1980年代にmRNAを脂肪滴を使って標的に送達することで、薬剤として利用できるのではとの仮説が立てられた時にさかのぼります。 それ以来、ジカ熱、狂犬病、インフルエンザ、サイトメガロウイルスなど、さまざまな病原体を標的としたmRNAワクチンが設計されています。以下の 図1では、細胞および抗体を介して免疫を誘導するmRNAワクチンの作用機序を概説しています。
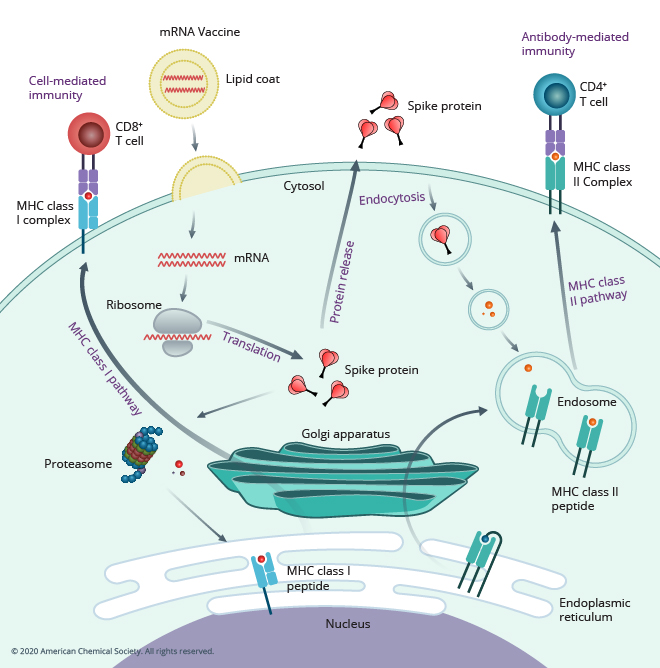
宿主細胞で免疫反応を引き起こす抗原タンパク質を直接導入する従来型のワクチン手法とは異なり、mRNAワクチンでは、疾患固有の抗原を符号化するmRNAを導入し、宿主細胞が持つタンパク質合成機構を活用することで、免疫反応を誘発する抗原を生産させるという方法を取ります。 体内にこのような外部の抗原が生産されると、免疫系がこのウイルスの抗原を認識してそれを記憶します。そうすることで、将来同じ抗原を持った本当のウイルスに感染したときに、それに戦えるようになるわけです。
mRNAワクチンが体内の細胞を用いてCOVID-19への免疫を生じさせる仕組みについては、この動画をご覧ください。
mRNAワクチン - 長く困難な道のり
COVID-19に対抗するmRNAワクチン技術の応用が成功したのは、生化学者や免疫学者、そして発生生物学者の先駆的研究なくしては、あり得ませんでした。 ただし、成功への道のりは長く困難でした。何十年にもわたって成果が上がらず、技術に対しても論争が絶えなかったのです。 研究者は当初、その不安定性からmRNAの技術で苦労をしていました。これは後ほど、脂質ナノ粒子(LNP)の開発でほぼ克服されることになります。 mRNAをこの保護用の小さな脂肪の泡に封じ込めることで、そのmRNAは分解されずに細胞内の適切な場所に移動させることができるようになったのです。
mRNAワクチンは初期の研究では有望視されていました。ところが、ワクチンプラットフォームの最適化と規模拡大のためのコストが、大規模展開の大きな制約要因となっていました。 そういうこともあり、初期のmRNAワクチンの開発・実用化の試みは、製造上の問題から断念されました。これには、鳥インフルエンザワクチンなども含まれています。 ワクチン候補の多くはヒトを対象とした研究まで至らず、シャイアー社やノバルティス社など、mRNAワクチンのポートフォリオを売却してしまうところもありました。 企業は、この技術に経済的可能性を見いだせなかったのです。
COVID-19 mRNAワクチンの登場
COVID-19のパンデミックは、ワクチン開発に多大な影響を与えました。 いきなり、mRNAは新型コロナウイルスSARS-CoV-2用のワクチンとして、急速にそして首尾よく展開されたのです。 組織的な研究の取り組みを通じて、2種類のmRNAワクチン候補がCOVID-19対策として緊急承認されることになりました。 これらのワクチンには、従来型ワクチンに比べていくつか長所がありました。それには、以下が含まれています。
- B細胞とT細胞両方の免疫反応を誘発させることにより、特異性と有効性が向上した。
- 細胞のない環境でin vitro転写(IVT)により大量に生産することが容易なため、より速い開発、より簡素化された製造工程、そしてよりコスト効率の高い製造が可能になった。
- 安全上の利点があった。つまり、宿主細胞のゲノムに組み込む必要がなく、DNAとの相互作用もないため(したがって宿主に突然変異のリスクがないため)、ウイルス粒子の形成がなく、抗原の一時的発現もない(体内での持続性が制限される)。
COVID-19のパンデミックに世界中の科学者が一丸となって取り組んだ結果、mRNAワクチンの開発は加速され、初期の研究の妨げとなっていた課題を克服することができたのです。 今回のパンデミックから得た知識はワクチン技術の分野と、RNA手法を用いた未来のワクチン設計を生み出す研究において、たいへん価値があります。
mRNAワクチン開発パイプライン
COVID-19 mRNAワクチンの成功に後押しされ、約90のリード開発者が膨大な数の病原体に対するmRNAワクチン候補を開発しています。 モデルナ社だけでも、同社が開発しているmRNAワクチンには、ターゲットとしてEBウイルス、サイトメガロウイルス、季節性インフルエンザ、呼吸器合胞体ウイルスなどが並んでいます。 また、単純ヘルペスウイルス、多発性硬化症、がん、ヒト免疫不全ウイルスに対するmRNAワクチン開発の計画もあります。 mRNAベースの初のマラリアワクチンの臨床試験が今年開始される予定で、これは長年放置されてきた病気対策への希望となっています。 この技術の応用は、無限の可能性を秘めています。
開発パイプラインをちょっと見てみるだけで、修飾・非修飾・自己増幅型mRNAなど、さまざまな形式のmRNA技術が探求されていることがわかります。 LNPによるフォーミュレーションは、依然としてmRNAを標的へ送達する最も一般的な方法ですが、カチオン性ナノエマルジョンや高分子など、ほかの送達手段も検討されています。 これらの新しいフォーミュレーションのほうが安定性、効力、免疫原性、結合価において優位性をもたらすと開発者により考えてられているためです。 ただし、mRNAワクチン候補の約4分の3が前臨床/探索段階にあるため、これらの新技術が臨床試験でどのような結果をもたらすかわかるまでには、まだ数年かかります。
将来に向けたmRNAワクチンの最適化
ここ数年で、mRNAワクチンの分野は大きく進歩してきたとはいえ、プロセス開発上の課題はいくつか残っています。例えばプラスミドDNAの供給、in vitro転写とカプセル化プロセスの複雑さ、多様なmRNA不純物の特性、超低温保存の必要性、などです。
それに、その継続的なイノベーションの必要性を高めるその他の要因も存在します。例えば、ウイルス変異体の出現リスク(これはCOVID-19で実際に見られました)、SARS-CoV-2ワクチン接種者における高用量投与の必要性、投与後の注射部位反応、といった要因です。
安定性
安定性は重要な特性であるにもかかわらず、LNP-mRNAやタンパク質mRNA複合体などのmRNA製剤の安定性プロファイルを調査する研究は、mRNAの完全性に対する凍結乾燥の影響を調査した研究がいくつか存在する程度で、あとは最低限しか行われてきていません。 その他の手法には、mRNAの噴霧乾燥や lyosphere (溶媒圏、mRNAを凍結乾燥させた液滴)の生成などがあります。 この研究分野は、今後のmRNAワクチンの大規模実施には不可欠なものです。
コスト
前述したように、初期のmRNAワクチンの開発ではコストが大きな制約となっていました。そしてそれは今後も重要な検討事項となっていくでしょう。 現在では、比較的大量のRNAがワクチンの製造に必要なため、時間とコストがかかるだけでなく、潜在的な副作用の可能性も高くなります(詳細は後述)。 さらに、超低温保管(-70°C)が必要なためコストがかかり、また流通やワクチン接種の拠点でも特殊な冷凍庫が必要なため、普段は設置されてない場所もあります。 ただし、mRNAワクチンに必要な製造インフラおよび原材料に投資することで、ワクチンのコストをいずれ引き下げることができると研究者は予測しています。
少用量化
RNA低用量化に伴う課題を克服するひとつの方法として、自己増幅型RNAを使用することが挙げられます。
それは、構造的にRNAに類似していて、ただサイズは大きいもののレプリカーゼをコードしてあるので、細胞内に送達されると元のRNA鎖の増幅を行います。 その結果、最小限のRNAの用量でタンパク質の収率が大幅に向上し、コストと効率の面でさらなるメリットがもたらされます。 ただし、潜在的な課題として、その分子のサイズと、そのために起きる送達時における影響があります。
mRNAワクチンは長年使用されてきましたが、グローバルなパンデミックが起こるまで、その臨床的な可能性は未開拓のままでした。 ところがこの数年で、この領域は大幅に進歩しました。 今後、新世代のmRNAワクチンを製造するために何が必要かということを考えると、何が優先されるべきかは明らかです。 今後も、この領域での進展が注目されます。
mRNAワクチン以外の治療
mRNAワクチン以外のRNA由来治療法についてより深く理解するには、弊社のInsights Report、『RNA由来の医薬品 - その研究トレンドと開発の考察』をご覧ください。RNAの医療への応用をはじめ、化学修飾やナノテクノロジーによっていかにRNA医薬品の送達と有効性が強化されるか、といったことなどについて解説されています。