Obtenga nuevas perspectivas para un progreso más rápido directamente en su bandeja de entrada.
En el contexto actual de mayor concienciación sobre los virus a causa de la pandemia de COVID-19, las noticias sobre brotes de viruela del mono en todo el mundo están haciendo saltar muchas alarmas. La viruela del mono es un virus que se detecta con frecuencia y que se circunscribe a la región de África Central y Occidental. En esta ocasión, sin embargo, el virus se ha propagado de forma inusual y ha afectado a poblaciones que no eran vulnerables en el pasado. Actualmente, hay más de 300 casos confirmados o posibles en al menos 19 países no africanos, y se están investigando muchos más. La CAS Content Collection™ ofrece información única sobre la viruela del mono, el panorama de la investigación, las opciones terapéuticas y los perfiles científicos de virus similares.
¿Qué es la viruela del mono?
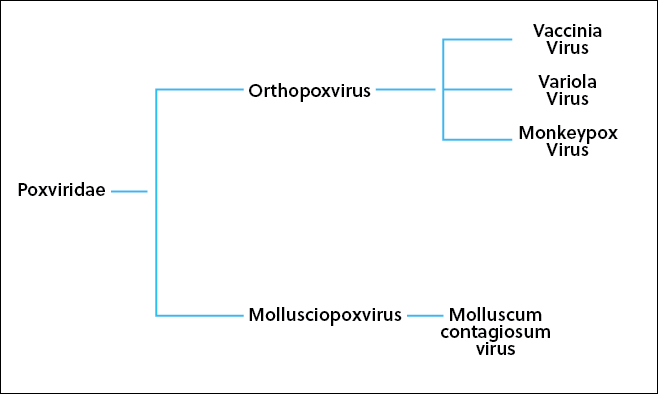
El virus de la viruela del mono pertenece a la familia Poxviridae y al género Orthopoxvirus. En la CAS Content Collection es posible consultar la filogenia del virus de la viruela del mono. Pertenece a la misma familia que el virus que causa una enfermedad cutánea frecuente en la infancia —Molluscum contagiosum— y al mismo género que otros virus, como los virus de la viruela bovina —Vaccinia virus— y la viruela —Variola virus—. Sin embargo, no está relacionado con el virus conocido comúnmente como virus de la varicela —Varicella-zoster—. Se descubrió por primera vez en 1958, en colonias de monos en investigación que desarrollaron una enfermedad similar a la viruela, y el primer caso humano se registró en la República Democrática del Congo (RDC) en 1970. Todos los casos posteriores fuera de los países endémicos se habían producido exclusivamente a raíz de viajes de personas con origen en estos países o de la importación de animales infectados procedentes de estos países. La viruela del mono se considera una enfermedad zoonótica cuya transmisión se produce principalmente de animales a personas o viceversa. Este brote actual, sin embargo, ha derivado en la transmisión entre personas en países no endémicos, lo que ha causado mucho desconcierto y ha hecho que esta enfermedad poco frecuente salte a los titulares de prensa.
Panorama de la bibliografía publicada sobre la viruela del mono
El análisis de la CAS Content Collection revela que la investigación sobre el género Orthopoxvirus comenzó a intensificarse a finales de la década de 1980 y que hay 30 000 artículos en revistas y patentes disponibles en esta categoría. Como cabe suponer, el volumen de publicaciones sobre la viruela del mono es mucho menor, con alrededor de 1200 artículos de revistas y patentes; no obstante, la investigación sobre esta enfermedad experimentó un ligero aumento a principios de la década de 2000 y se mantuvo relativamente estable desde 2003 hasta 2021.
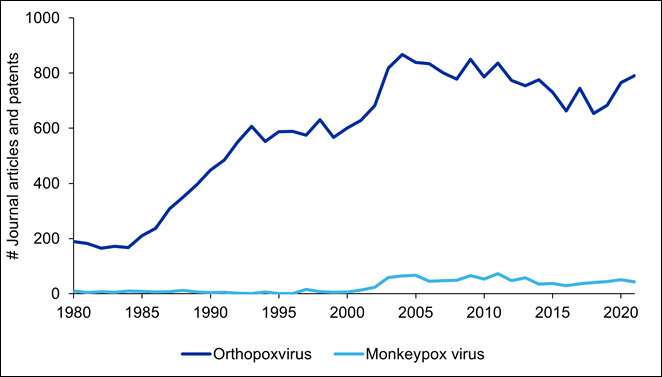
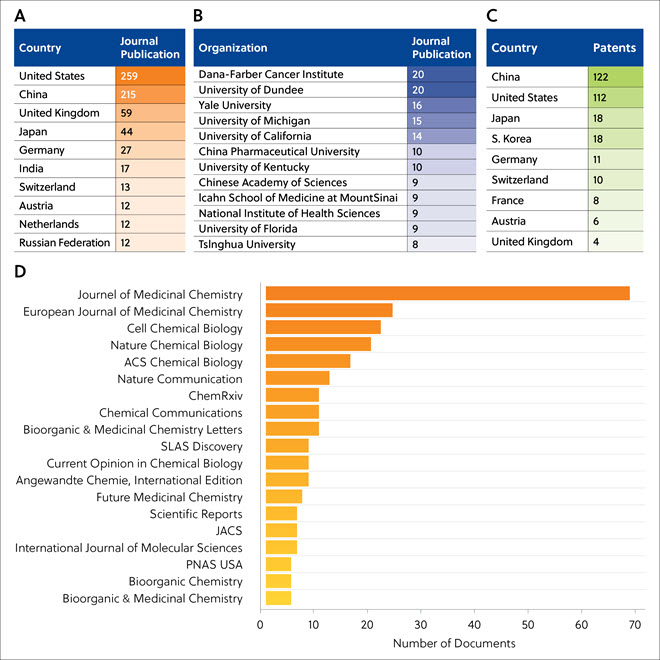
Tabla 1. Principales diez empresas e institutos de investigación que han estudiado el virus de la viruela del mono.
| Empresa o instituto de investigación | Número de artículos y patentes |
| Institutos Nacionales de Salud (NIH) de Estados Unidos |
38 |
| Centros para el Control y la Prevención de Enfermedades (CDC) de Estados Unidos | 35 |
| Instituto de Investigación Médica de Enfermedades Infecciosas del Ejército de Estados Unidos (USAMRIID) | 26 |
| Universidad de Saint Luis | 14 |
| Robert Koch Institute | 9 |
| Universidad de Ciencia y Salud de Oregón | 7 |
| Universidad del Sur de Illinois | 7 |
| Chimerix Inc. | 6 |
| La Jolla Institute for Immunology | 6 |
| Universidad Estatal de Utah | 6 |
¿Cómo se transmite la viruela del mono?
El virus de la viruela del mono es un virus de ADN bicatenario (ADNbc) con un genoma que consta de unas 190 kb. Esto contrasta con el virus SARS-CoV-2, que es un virus de ARN monocatenario con un genoma de aproximadamente 30 kb. Como ya sabemos todos, el SARS-CoV-2 es tan pequeño que puede atomizarse y desplazarse más de dos metros por el aire. El virus de la viruela del mono, en cambio, tiene un tamaño mucho mayor, no se atomiza y, por tanto, apenas se desplaza un metro antes de caer al suelo. Tampoco permanece suspendido en el aire como el SARS-CoV-2. Para que se produzca la transmisión de una persona a otra a través del aire, es necesario un contacto prolongado, frente a frente, con una persona infectada. También puede transmitirse por contacto directo con fluidos corporales o heridas, o por exposición indirecta a materiales que hayan estado en contacto con heridas, como prendas de vestir o ropa de cama. La transmisión de animal a persona puede producirse por mordeduras o arañazos, manipulación de carne y por el contacto directo o indirecto con fluidos corporales o lesiones de un animal infectado. Este virus entra en el organismo a través de la piel lesionada, las vías respiratorias o las membranas mucosas. Otra diferencia favorable con el SARS-CoV-2 es que el virus de la viruela del mono muta a una velocidad mucho más lenta, debido a que se trata de un virus de ADN de tamaño mucho mayor. Esta diferencia hace que las vacunas anteriores y actuales sean muy eficaces.
Perfiles genéticos de la viruela del mono actual
Por lo general, los virus de ADN son estables y mutan muy despacio en comparación con los virus de ARN. Un grupo de investigadores de Portugal dio a conocer el primer borrador del genoma el 19 de mayo de 2022, y publicó nueve secuencias adicionales del genoma del virus de la viruela del mono que está causando el brote actual en varios países el 23 de mayo. El borrador preliminar vigente de la secuenciación genómica revela que el brote actual proviene de la cepa estándar de África Occidental y que está estrechamente relacionado con la cepa del virus de la viruela del mono que se vinculó con la exportación de animales desde Nigeria a varios países en 2018 y 2019. Los científicos observaron que el brote actual muy probablemente proviene de un solo origen, pero también que difiere de la secuencia de 2018/2019 al presentar 50 pequeños polimorfismos de nucleótido único (SNP). También descubrieron los primeros signos de microevolución en este clúster del brote, con la aparición de siete SNP que llevaron a la formación de tres ramas descendentes que incluían otro subclúster de dos secuencias. Además, determinaron que este subclúster de dos secuencias tiene una mutación en el marco de lectura (deleción de 913pb) que parece correlacionarse con la transmisión de persona a persona. Es posible que esta microevolución permita que esta secuencia genómica ofrezca una resolución suficiente para rastrear la propagación del virus durante este brote, lo que con frecuencia no es posible con otros virus de ADNbc.
Vacunas y posibles tratamientos para la viruela del mono
Aunque las vacunas no estarán disponibles con carácter inmediato para la población general, el gobierno estadounidense está cediendo vacunas JYNNEOS de la Reserva Nacional Estratégica para determinados contactos de alto riesgo de los primeros enfermos. En la tabla 2 se resumen las vacunas y los posibles tratamientos actuales.
Tabla 2. Vacunas y posibles tratamientos para la viruela del mono.
| Nombre y número CAS Registry Number | Notas |
| Vacunas | |
|
JYNNEOS (Imvamune/Imvanex)* 1026718-04-6 |
Autorizada en Estados Unidos para la prevención de la viruela del mono y la viruela. Efectividad mínima del 85 % en términos de prevención de la viruela del mono. |
|
ACAM2000* 860435-78-5 |
Se puede utilizar en personas expuestas a la viruela del mono, siempre que se haga en el marco de un protocolo de investigación clínica de nuevo fármaco de acceso ampliado. Autorizada para la inmunización de personas de 18 años o más que presentan riesgo alto de infección por el virus de la viruela. |
| Posibles tratamientos | |
|
Cidofovir 113852-37-2 |
Actividad probada contra los virus de la familia Poxviridae, según estudios in vitro y en animales. Toxicidad renal como efecto adverso. |
| Brincidofovir (CMX001) 444805-28-1 |
Actividad probada contra los virus de la familia Poxviridae, según estudios in vitro y en animales. Perfil de seguridad mejorado respecto al del cidofovir. |
| Tecovirimat (ST-246) 869572-92-9 |
Los estudios en animales han demostrado su eficacia en el tratamiento de la enfermedad causada por virus del género Orthopoxvirus. Los ensayos clínicos en humanos han demostrado su seguridad y tolerabilidad, con unos efectos secundarios mínimos. Aunque actualmente se almacena en la Reserva Nacional Estratégica, su uso solo es posible en el marco de un protocolo de investigación clínica de nuevo fármaco. |
| Inmunoglobulina de Vaccinia (VIG) | El uso de VIG se realiza en el marco de un protocolo de investigación clínica de nuevo fármaco; no se ha demostrado ningún beneficio en el tratamiento de las complicaciones de la viruela. Puede sopesarse el uso profiláctico de VIG en personas expuestas con inmunodeficiencia grave de la función de los linfocitos T para las que la vacunación contra la viruela tras la exposición a la viruela del mono está contraindicada. |
Panorama actual
Cuando la Organización Mundial de la Salud anunció la erradicación de la viruela en 1980, se puso fin al programa de erradicación de esta enfermedad en todo el mundo. La inmunidad proporcionada por la vacuna de la viruela, como ocurre con cualquier vacuna, disminuye con el tiempo; además, a las personas nacidas después de 1980 no se les administró la vacuna, por lo que no están protegidas contra el virus de la viruela del mono. La investigación revela que 30 años después de la conclusión de las campañas de vacunación contra la viruela en la República Democrática del Congo se produjo un importante aumento de la incidencia de infección por el virus de la viruela del mono en humanos. Aunque este dato —unido al hecho de que se ha investigado menos sobre la viruela del mono— puede suponer un motivo de preocupación para algunos, cabe mencionar que se han estudiado exhaustivamente otros virus de la misma familia. La vacunación, las opciones de tratamiento y la menor transmisibilidad apuntan a que la situación planteada por este brote es controlable y, por tanto, debería ser posible reducir su impacto global. Todavía no se han identificado todos los casos del brote, pero gracias a la concienciación sobre los virus y las medidas de prevención de salud pública, es de esperar que el virus de la viruela del mono deje de propagarse entre los países no endémicos.