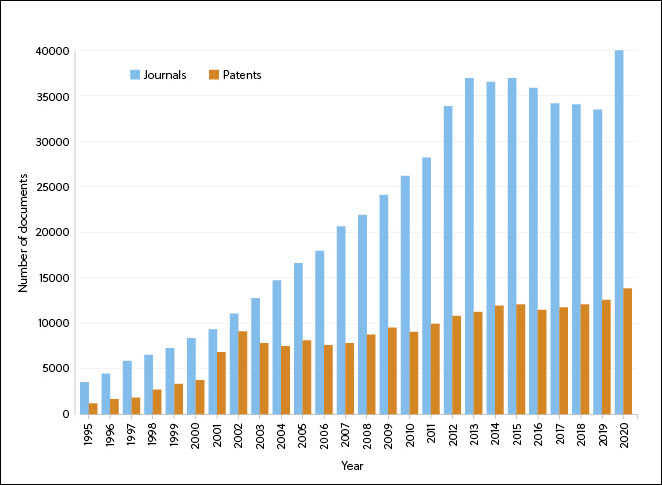
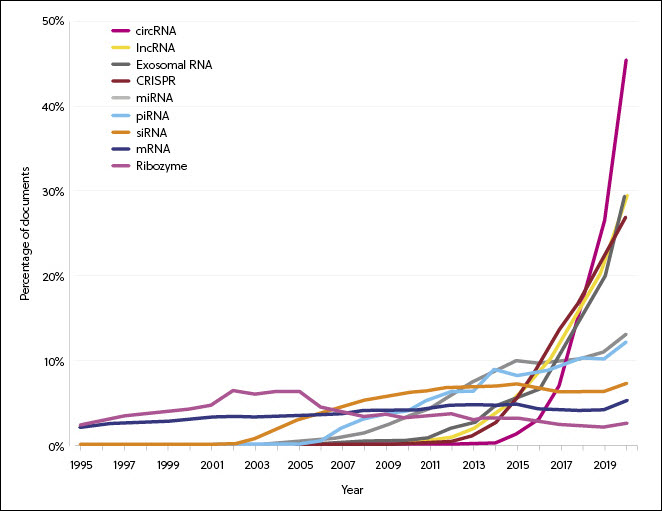
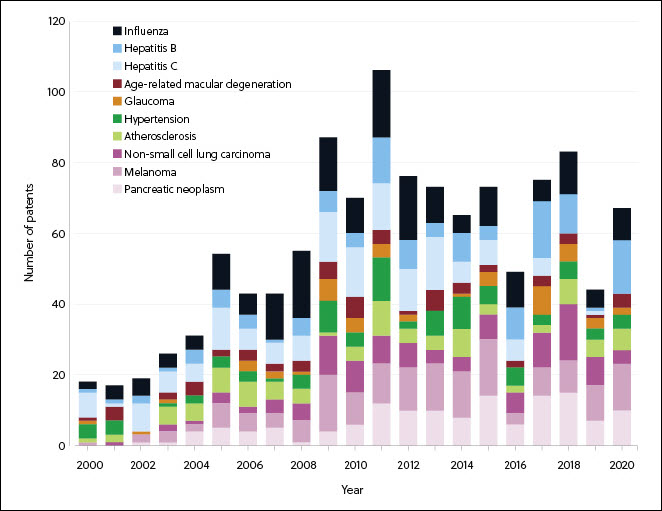
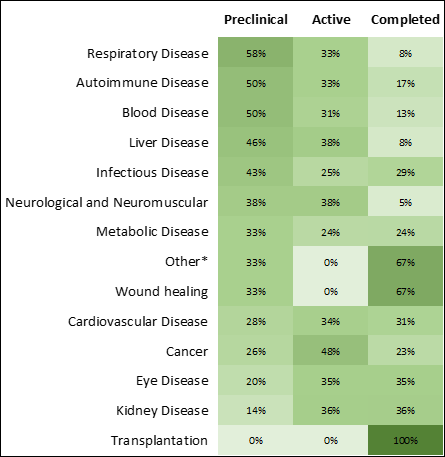
새로운 COVID-19 치료법 개발 기회 가속화
현재 승인된 COVID-19 치료법은 많지 않습니다. 새로운 치료법에 수십 년의 시간과 수십억 달러의 비용이 소요되는 것을 감안할 때 기존 약물의 용도 변경으로 새로운 치료법을 개발할 수 있는 방법은 없을까요? 최신 CAS Insights 보고서에서 CAS Knowledge Graph로 용도 변경이 가능한 약물을 식별하는 통찰력과 새로운 연결 관계를 알아봅니다.
약물 재창출은 빠른 치료법 개발에 중요한 역할을 합니다. 그러나 새로운 단백질, 바이러스, 표적, 경로 및 임상 자료와 관련된 모든 중요 정보와 연결 고리를 조합하기는 어려울 수 있습니다. 이 글은 CAS Knowledge Graph로 COVID-19 치료법을 위해 용도 변경을 고려할 수 있는 주요 임상 후보를 식별하는 방법을 설명합니다.
지식 그래프란?
지식 그래프는 개별 소스의 데이터를 결합하여 특정 영역을 모델링하며, 데이터를 노드와 엣지로 설명합니다. 노드는 각 데이터 지점을 나타내고 엣지는 노드의 관계를 나타냅니다. 아래 이미지는 혈관 염증을 억제할 수 있는 약물을 보여주는 간단한 지식 그래프 예입니다.
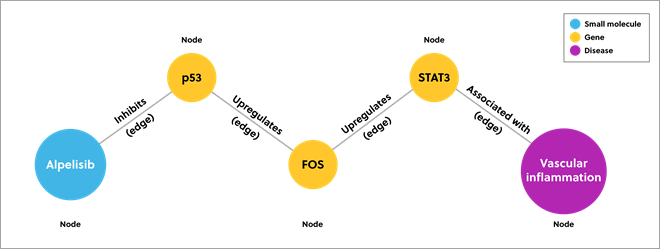
그림 1. 노드와 엣지를 사용하여 데이터 연결 관계를 보여주는 지식 그래프 예
전통적인 데이터베이스는 직접적인 연결 관계만 보여줄 수 있지만(전사 인자 STAT3의 직접 억제제) 지식 그래프는 보다 심층적인 데이터 연결 관계를 보여줄 수 있습니다. 이 예의 지식 그래프는 억제제의 간접적인 영향까지 보여줍니다.
COVID-19 심층 연구: 저분자 신약 개발
CAS Biomedical Knowledge Graph는 엄선된 CAS Content CollectionTM의 데이터와 공개된 생체 의학 데이터를 결합한 결과를 보여줍니다.
6백만 개가 넘는 저분자, 24,000여 질병, 26,000가지 인체 및 바이러스성 유전자에 대한 고품질 데이터를 제공합니다. 지식 그래프는 전통적인 연구 방법으로 불가능한 정보를 제공합니다.
CAS Knowledge Graph 활용에 있어 COVID-19의 잠재적 약물 후보를 발굴하기 위한 2가지 기본 요소는 다음과 같습니다.
- CAS 과학자가 COVID-19와 연관된 20가지 생물학적 프로세스를 식별했습니다. 대표적인 프로세스는 혈액 응고, 바이러스 침투, 내포 작용입니다. 질병 노드 중 하나는 중증 COVID-19의 중요 병리학적 측면인 "사이토카인 폭풍"을 나타냈습니다.
- 문헌에 나타난 유전자 발현의 변화, 구체적으로는 SARS-CoV-2 감염으로 크게 과발현된 유전자. 이러한 유전자는 관련 생물학적 프로세스와 해당 유전자 중 4가지 이상과 연관된 생물학적 프로세스를 식별하는 데 사용되었습니다. 주요 프로세스는 염증 반응, 혈관형성, RNA 전사의 음성 조절입니다.
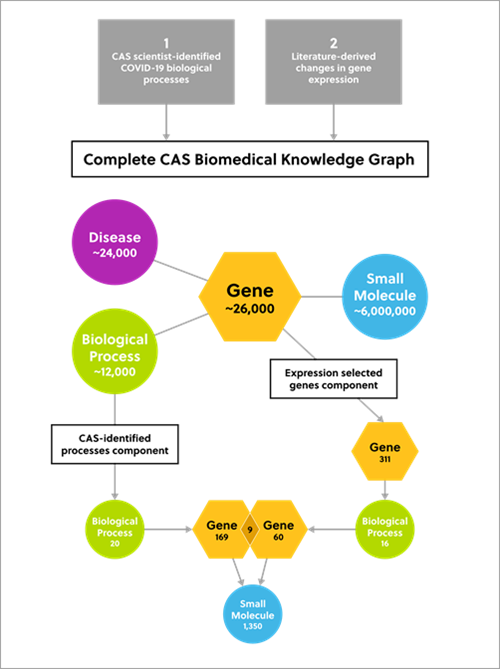
그림 2. COVID-19 치료에 필요한 잠재적 저분자 약물 후보를 식별하기 위한 2-요소 접근 방식을 보여주는 다이어그램
지식 그래프로 파악할 수 있는 정보는 다음과 같습니다.
- 해당 생물학적 프로세스와 억제 또는 활성화 관계를 갖는 모든 저분자
- 과발현된 유전자를 억제한 모든 저분자
분석 결과, COVID-19 치료법으로서의 용도 변경 가능성이 있는 1,350개 저분자를 식별했습니다.
COVID-19의 새로운 잠재적 치료법 평가
가능성이 있는 분자를 식별하면 연결 관계가 미치는 영향을 평가하고 그에 따라 점수를 올렸습니다. 이 작업을 위해 새로운 알고리즘 방법을 사용하여 각 분자의 순위를 정했습니다. 방정식을 사용하여 저분자 간 관계와 2-요소 접근 방식에서 식별된 유전자와 생물학적 프로세스의 상관관계를 평가했습니다.
예를 들어 사이토카인 폭풍을 중요한 연결 관계로 고려했습니다. 그런 다음 저분자 간 관계와 2-요소 접근 방식에서 식별된 유전자와 생물학적 프로세스의 상관관계를 평가했습니다. 사이토카인 폭풍, 유전자와 활성화 관계를 갖는 저분자와 같은 중요한 연결 관계에는 그 발생 희귀성을 고려하여 가산점을 적용했습니다.
그 결과, 모든 저분자의 순위표를 개발할 수 있었으며 정식 보고서에 상위 50개 저분자를 발표했습니다. 아래 그림 2에는 분석 결과에 따라 점수를 매긴 상위 10가지 약물 후보가 나와 있습니다. 노드 크기는 다른 노드와의 연결 수를 나타냅니다.
그림 3. 분석 결과에서 가장 높은 점수를 얻은 10개 약물 후보의 연결 관계를 보여주는 네트워크 다이어그램(노드 크기는 다른 노드와의 연결 수를 나타냄)
순위표에서 식별된 상위 50개 약물 중에서 현재 11개 약물에 대해 COVID-19 치료를 위한 임상 테스트가 진행되고 있습니다. 이는 CAS의 분석 결과를 확인시켜 주는 것입니다.
CAS의 생의학 지식 그래프는 SARS-CoV-2 또는 일반적인 바이러스 감염 메커니즘과 과거 연결 관계가 있는 4가지 약물군을 보여줍니다. 이 4가지 약물군은 다음과 같습니다.
키나아제 억제제
분석 결과에서 가장 많이 나타난 단일 약물군입니다. 키나아제는 거의 모든 생물학적 프로세스와 관련이 있으며 많은 질병에서 그 활동이 조절 장애를 보입니다. 수용체 티로신 키나아제(RTK)는 많은 바이러스의 세포 침투에 관여합니다. EGF, FGF, PDGF 및 ALK 수용체와 같은 RTK, 브루톤 티로신 키나아제와 같은 비수용체 티로신 키나아제에 영향을 미치는 키나아제 억제제가 식별되었습니다. 수용체 B-RAF, PKC, PIM, GSK-2beta가 표적인 세린-트레오닌 키나아제 억제제 또한 CAS 지식 그래프로 식별되었습니다.
히스톤 디아세틸라제 억제제(HDI)
HDI는 히스톤 탈아세틸화를 줄여 유전자 발현을 조절합니다. HDI는 SARS-CoV-2의 주 세포 표면 수용체인 안지오텐신 전환 효소 2(ACE2)와, COVID-19의 알려진 위험 인자이면서 혈액형 결정에 영향을 미치는 ABO 글리코실 전달 효소의 발현을 모두 줄여줍니다. HDI는 또한 COVID-19의 면역 반응에 관여하는 여러 케모카인과 사이토카인을 조절합니다. 따라서 분석 결과에 포함되는 것이 논리적으로 타당합니다.
미세소관 조절제
미세소관은 튜불린 아단위로 구성된 필라멘트입니다. 여러 연구 결과, SARS-CoV-2 단백질이 미세소관 또는 미세소관 관련 단백질과 상호작용한다는 사실이 밝혀졌습니다. CAS 연구에서는 도세탁셀, 콜키신, 메벤다졸과 같은 미세소관 조절제가 SARS-CoV-2 감염을 차단하는 데 사용될 수 있다는 점이 확인되었습니다. 콜키신은 이미 COVID-19 환자 치료를 위한 임상 시험에 들어갔습니다.
프로테아제 억제제
식별된 프로테아제 억제제의 대부분은 프로테아좀 억제제였습니다. 연구에 따르면 유비퀴틴-프로테아좀 시스템이 바이러스 복제와 사이토카인 폭풍, 코로나바이러스 관련 질병에 관여하는 것으로 알려졌습니다. 프로테아제 억제제는 COVID-19와의 관련성을 연구하기 위한 논리적인 선택입니다. 실제로 그러한 여러 억제제가 이미 COVID-19 치료법으로 연구되고 있습니다. 보르테조밉, 카필조밉, 삭사글립틴 등도 CAS 연구에서 관련 억제제로 확인되었습니다.
연결의 힘
CAS 지식 그래프를 활용하는 방법은 COVID-19 치료를 위한 잠재적인 약물 식별을 강화하며 COVID-19를 넘어 알츠하이머병, 파킨슨병, 자가면역질환, 암을 비롯한 희귀 질환 등 다양한 질병의 신약 개발에 큰 가치를 발휘할 것입니다. CAS 지식 그래프는 확장 가능한 모듈 방식으로 화학, 영양, 재생 에너지를 포함한 모든 과학 분야에서 훌륭한 가치를 제공합니다. 활용 기회는 무궁무진합니다.