Gain new perspectives for faster progress directly to your inbox.

La charge mondiale croissante du cancer
La charge du cancer et de la mortalité associée augmente rapidement dans le monde entier, sous l'effet du vieillissement de la population et des changements en termes de prévalence et de répartition des principaux facteurs de risque du cancer. On prévoit que 28,4 millions de cas de cancer seront diagnostiqués en 2040, soit une hausse de 47 % par rapport à 2020.
Le cancer du sein chez la femme dépasse maintenant le cancer du poumon en termes de nombre de cancers diagnostiqués, et on estime que 2,3 millions de nouveaux cas seront détectés en 2020 (11,7 %), suivi par les cancers du poumon (11,4 %), colorectal (10 %), de la prostate (7,3 %) et de l'estomac (5,6 %). Les immunothérapies, telles que les inhibiteurs des points de contrôle, constituent un progrès essentiel dans le traitement du cancer. Malgré cette avancée, l'immunothérapie n'est pas une panacée contre tous les cancers. Tous les types de tumeur ne réagissent pas aux agents immunothérapeutiques et les mécanismes de résistance peuvent aboutir à une évasion immunitaire et à une croissance de la tumeur.
Même si aucun vaccin à ARNm contre le cancer n'est actuellement approuvé par la Food and Drug Administration aux États-Unis, la désignation de thérapie révolutionnaire a été accordée à un vaccin expérimental, le mRNA-4157-P201 (Moderna) combiné à l'inhibiteur de point de contrôle pembrolizumab (Merck) comme traitement adjuvant contre le mélanome à haut risque à la suite d'une résection complète. Depuis le succès des vaccins à ARNm contre la COVID-19, les chercheurs sont convaincus que la technologie des vaccins à ARNm peut être exploitée pour traiter les cellules cancéreuses. Cela dit, pourrions-nous être proches d'une intégration des traitements à ARNm dans le paysage des traitements contre le cancer ?
La boucle est bouclée : vaccins à ARNm et cancer
Beaucoup de gens pensent que les vaccins à ARNm contre la COVID-19 ont été développés du jour au lendemain. Toutefois, la conception, la fabrication et les tests rapides de ces vaccins n'auraient pas été possibles sans des années de recherche qui avaient permis de jeter les bases des vaccins contre la grippe, le cytomégalovirus et le Zika.
En 1995, une recherche déterminante a démontré qu'une injection intramusculaire d'antigènes carcinoembryonnaires codant l'ARN nu pouvait provoquer des réactions des anticorps spécifiques aux antigènes chez la souris. L'année suivante, une étude distincte a démontré que l'injection de cellules dendritiques transfectées avec ARNm chez des souris porteuses de tumeur induisaient des réponses des lymphocytes T et inhibaient la croissance de ces tumeurs. Ces travaux ont ouvert la voie à de nombreuses études au sujet de la faisabilité, de l'efficacité et de l'innocuité des technologies à base d'ARNm. Toutefois, jusqu'à une époque récente, l'immunogénicité innée et une administration in vivo inefficace limitaient les vaccins et les applications thérapeutiques de l'ARNm. Les chercheurs se heurtaient à un obstacle majeur : comment administrer l'ARNm à l'endroit voulu ? Une séquence d'ARNm injectée dans l'organisme sans aucune forme de protection aurait été considérée comme une substance étrangère et détruite.
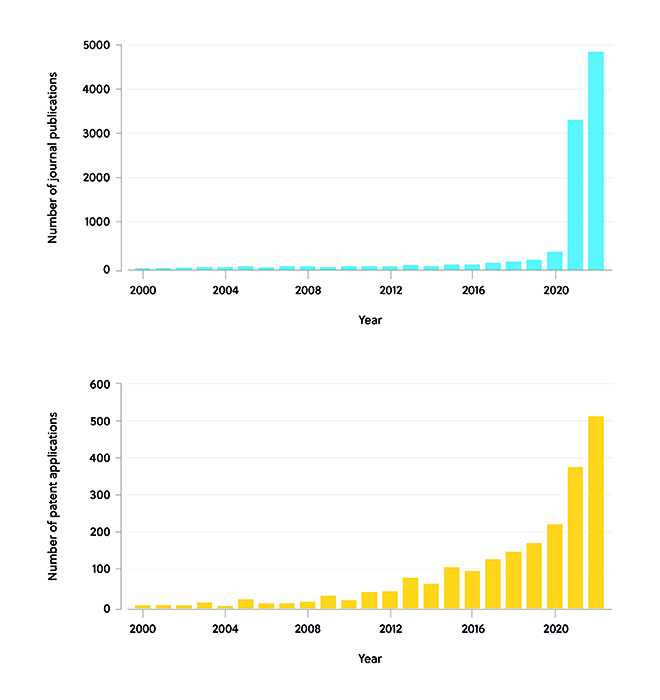
Le développement rapide des vaccins à ARNm pour traiter le nouveau coronavirus, ou SARS-CoV-2, a contribué à faire passer l'utilisation des vaccins à ARNm du laboratoire au patient. Par exemple, les vaccins Pfizer-BioNTech et Moderna ont démonté l'efficacité de l'utilisation de nanoparticules lipidiques (NPL) pour administrer l'ARNm dans les cellules ciblées. Fin 2019, stimulé par l'épidémie de SARS-CoV-2, le volume de la littérature publiée et des demandes de brevet liées à des traitements par ARNm a rapidement augmenté dans le monde entier. Après 2020, le nombre d'articles publiés a rapidement augmenté, atteignant 3 361 articles en 2021 et près de 5 000 en 2022. Le nombre de demandes de brevet a poursuivi sa trajectoire ascendante après 2020, atteignant 382 en 2021 ; il est estimé à 522 en 2022 (figure 1).
Le succès des vaccins à ARNm contre la COVID-19 a révélé le potentiel de la plateforme ARNm non seulement contre d'autres maladies infectieuses, mais aussi contre les cancers. Dans la mesure où les informations révélées par les études sur les virus pourraient influer sur les travaux sur les vaccins contre le cancer, il semble que la boucle soit bouclée.
Recrutement du système immunitaire — comment fonctionnent les vaccins à ARNm contre le cancer
Les applications des vaccins à ARNm contre le cancer sont nombreuses, et les chercheurs étudient plusieurs stratégies d'immunothérapie contre le cancer :
- Présentation d'antigènes : les vaccins à ARNm envoient des antigènes contre le cancer vers des cellules présentatrices d'antigènes (CPA) pour la présentation des complexes majeurs d'histocompatibilité de classe I et II.
- Fonction adjuvante : l'ARNm stimule l'activation immunitaire en se liant à des récepteurs de reconnaissance de motifs exprimés par les CPA.
- Récepteurs antigéniques : l'ARNm introduit dans les lymphocytes des récepteurs antigéniques comme les récepteurs d'antigène chimérique (RAC) et les récepteurs des lymphocytes T.
- Production de protéines : l'ARNm permet l'expression de protéines immunomodulatrices, y compris des récepteurs de type toll, les récepteurs de chimiokines, les ligands de costimulation, les cytokines, les chimiokines et différents formats d'anticorps monoclonaux dans divers sous-ensembles de cellules.
Les traitements anticancéreux à ARNm sont-ils à notre portée ?
Des laboratoires tels que Genentech, CureVac et Moderna développent actuellement des vaccins à ARNm avec codage des néo-épitopes aptes à susciter des réponses immunitaires contre des tumeurs ciblées. Des dizaines d'essais cliniques sont en cours pour tester des vaccins à ARNm soit en tant que monothérapies, soit dans le cadre d'un traitement combiné chez des personnes atteintes de différents types de cancer, notamment le cancer du pancréas, le cancer colorectal et le mélanome. Plusieurs candidats-vaccins en cours d'essai de phase 2 démontrent une efficacité favorable contre le mélanome, le cancer du poumon non à petites cellules et le cancer de la prostate (tableau 1).
Tableau 1. Vaccins à ARNm dans les essais cliniques contre le cancer (phase 2 et au-delà)
| Vaccin |
CAS Numéro de Registre® |
Indication thérapeutique |
Antigène | Laboratoire |
| Cevumeran autogène | 2365453-34-3 | Mélanome ; cancer colorectal |
Néo-antigènes spécifiques au patient |
BioNTech |
| ARNm 4157 | 2741858-84-2 | Mélanome | Jusqu'à 34 néo-antigènes | Moderna |
| BNT 113 | 2882951-85-9 | Carcinome épidermoïde de la tête et du cou PV16+ | Antigènes tumoraux dérivés de l'HPV16 (oncoprotéines E6 et E7) | BioNTech |
| CV 9202 | 1665299-76-2 | Cancer du poumon non à petites cellules | NY-ESO-1, MAGE C1, MAGE C2, TPBG (5T4), survivin, MUC1 | CureVac |
| CV 9103 | 2882951-83-7 | Cancer de la prostate | Mélange de quatre antigènes associés au cancer de la prostate | CureVac |
| SW 1115C3 | 2882951-82-6 | Cancer du poumon non à petites cellules ; cancer de l'œsophage | Néo-antigènes spécifiques au patient | Stemirna Therapeutics |
| BNT 111 | 2755828-88-5 | Mélanome | Mélange de quatre antigènes associés au mélanome | BioNTech |
Alors que les vaccins à ARNm contre le cancer suscitent de plus en plus d'intérêt parmi les chercheurs, l'essentiel de la recherche en oncologie s'est historiquement concentré sur les traitements à ARNm, avec une grande diversité de candidats-traitements qui sont entrés en phase de développement clinique (tableau 2), notamment :
- TriMix-MEL (eTheRNA Immunotherapies), mélange de trois ARNm qui activent des cellules immunitaires essentielles contre le cancer.
- Un traitement à ARNm (BioNTech) codant un anticorps monoclonal qui cible la claudine 18, une protéine exprimée dans de multiples cancers.
- Un ARNm encapsulé dans des NPL (MedImmune LLC) administré par injection intratumorale, visant à favoriser la production locale d'interleukine-12 (IL-12) et à induire une immunité anti-tumorale.
Tableau 2. Produits thérapeutiques à ARNm en cours d'essai clinique contre le cancer
| Nom du médicament à ARNm | CAS Numéro de registre | Indication thérapeutique | Laboratoire |
| TriMix-MEL ; ECL-006 ; E011-MEL | 2877674-59-2 | Mélanome | eTheRNA Immunotherapies |
| BioNTech-1 ; BNT 141 ; BNT-141 ; BNT141 | 2877707-22-5 | Tumeurs solides | BioNTech |
| BNT-142 ; BNT142 | 2877707-34-9 | Tumeurs solides | BioNTech |
| BNT-151 ; BNT151 | 2877709-82-3 | Tumeurs solides | BioNTech |
| BNT 152 ; BNT152 | 2877709-92-5 | Tumeurs solides | BioNTech |
| BNT 153 ; BNT153 | 2877709-93-6 | Tumeurs solides | BioNTech |
| MEDI1191 ; MEDI-1191 | 2877712-03-1 | Tumeurs solides | Moderna |
| mRNA-2752 | 2878461-50-6 | Tumeurs solides | Moderna |
| SAR-441000 | 2879301-17-2 | Tumeurs solides | Sanofi, BioNTech |
| SQZ-eAPC-HPV | 2879306-51-9 | VPH et tumeurs solides | SQZ Biotechnologies |
Transformer les vaccins à ARNm contre le cancer en réalité
Nous avons réalisé de gros progrès dans la technologie d'ARNm contre le cancer au cours des dernières années, mais certains obstacles fondamentaux subsistent. Tout d'abord, les vaccins à ARNm contre le cancer ont besoin de systèmes spécifiques de conditionnement et d'administration avec une affinité appropriée pour le tissu/l'organe ciblé. Les chercheurs évaluent actuellement des approches visant à faciliter cela, y compris l'association de fractions ciblant les organes et d'oligonucléotides. Même si les NPL sont les véhicules les plus étudiés pour administrer l'ARNm, leur application clinique a été entravée par des problèmes de cytotoxicité et par leur temps de circulation relativement court. En conséquence, d'autres systèmes d'administration intelligente (par ex. les exosomes) sont en cours d'évaluation pour améliorer la biodisponibilité, le chargement et la libération de la charge d'ARNm.
L'administration efficace de la charge d'ARNm ne suffit pas. Pour garantir une efficacité maximale, les chercheurs étudient des approches visant à renforcer l'expression des protéines in vivo. Toutes les parties de l'ARNm - le cap, les régions 5' et 3', le cadre de lecture ouvert et la queue polyadénylée - peuvent être optimisées pour augmenter l'expression des protéines. Des nucléosides chimiquement modifiés semblent prometteurs dans ce domaine.
Outre la quantité d'expression des protéines, un défi majeur des vaccins à ARNm concerne la période relativement courte de la production de protéines, qui nécessite des administrations répétées. On étudie des ARNm auto-amplificateurs et circulaires en tant que stratégies pour prolonger la durée de vie de l'ARN et augmenter la production totale de protéines.
Même s'il reste beaucoup à faire, les vaccins à ARNm constituent une option clinique polyvalente pour traiter différents types de cancer lorsqu'ils sont utilisés seuls ou en association avec des options thérapeutiques existantes, comme les inhibiteurs des points de contrôle. Alors que nous anticipons la mise sur le marché des premiers traitements à ARNm, il sera intéressant d'explorer les résultats des nombreuses stratégies innovantes visant à lutter contre la charge mondiale du cancer.
Pour en savoir plus sur les vaccins et les traitements à ARNm, lisez notre article révisé par les pairs publié dans ACS Pharmacology and Translational Science.