Gain new perspectives for faster progress directly to your inbox.

La creciente carga global del cáncer
La carga del cáncer y la mortalidad asociada están creciendo con rapidez en todo el mundo, impulsadas por el envejecimiento de la población y por los cambios en la prevalencia y la distribución de los principales factores de riesgo para esta enfermedad. Se prevé que en 2040 se diagnosticarán 28,4 millones de casos de cáncer, un aumento del 47 % con respecto a 2020.
El cáncer de mama femenino ha superado al cáncer de pulmón como tipo de cáncer más diagnosticado, y se estima que en 2020 ha habido 2,3 millones de casos nuevos (11,7 %), solo por delante del cáncer de pulmón (11,4 %), el colorrectal (10,0 %), el de próstata (7,3 %) y el de estómago (5,6 %). Las inmunoterapias, como los inhibidores de puntos de control, han supuesto un avance crucial en el tratamiento del cáncer, pero, a pesar de la importancia de este descubrimiento, no han sido la panacea para todos los tipos de cáncer. No todos los tipos de tumores responden a los agentes inmunoterapéuticos, y los mecanismos de resistencia pueden llevar a la evasión y el crecimiento del tumor frente al ataque del sistema inmunitario.
Aunque la Food and Drug Administration (FDA) de EE. UU. no ha aprobado ninguna vacuna de ARNm para el uso contra el cáncer, se ha otorgado la designación Breakthrough Therapy a la vacuna en investigación mRNA-4157-P201 (Moderna) en combinación con el inhibidor de punto de control pembrolizumab (Merck) como adyuvante en melanomas de alto riesgo tras la resección total. Tras el éxito de las vacunas de ARNm contra la COVID-19, los investigadores creen que la tecnología de las vacunas de ARNm se podría usar para tratar las células cancerígenas. Así pues, ¿podríamos estar cerca de integrar las terapias de ARNm en el panorama del tratamiento del cáncer?
El círculo se cierra: vacunas de ARNm y cáncer
Muchas creen que las vacunas de ARNm contra la COVID-19 se desarrollaron de un día para otro. Sin embargo, el rápido proceso de diseño, fabricación y prueba de estas vacunas no habría sido posible sin los años de investigación que posibilitaron la creación de las vacunas de la gripe, el citomegalovirus y el Zika.
En 1995, una investigación decisiva demostró que una inyección intramuscular de ARN desnudo con capacidad para codificar antígenos carcinoembrionarios podía provocar una respuesta de generación de anticuerpos específicos de los antígenos en ratones. Un año después, otro estudio mostró que las células dendríticas transfectadas con ARNm inyectadas en ratones con tumores inducían una respuesta inmunitaria de linfocitos T e inhibían el crecimiento de esos tumores. Este trabajo preparó el terreno para numerosos estudios que exploraban la viabilidad, la eficacia y la seguridad de las tecnologías basadas en el ARNm. Sin embargo, hasta hace poco, la inestabilidad, la capacidad inmunógena innata y la ineficiencia de la administración in vivo han limitado las aplicaciones vacunales y terapéuticas del ARNm. Un desafío esencial al que se enfrentaron los investigadores era el de administrar el ARNm en el punto exacto en el que se necesitaba; una secuencia de ARNm inyectada en el cuerpo sin alguna clase de protección sería identificada como un sustancia extraña y destruida.
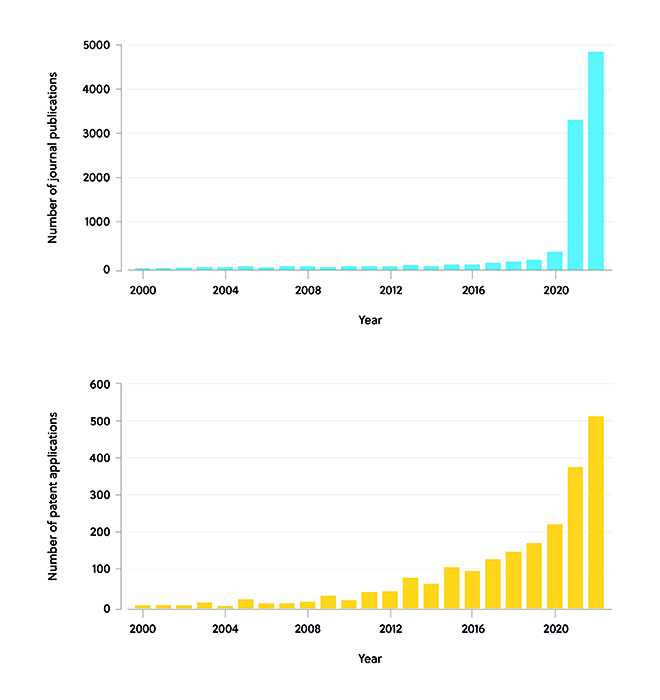
El rápido desarrollo de las vacunas de ARNm para tratar el nuevo coronavirus, el SARS-CoV-2, ha ayudado a acelerar el salto de las vacunas de ARNm del laboratorio al ámbito clínico. Por ejemplo, las vacunas de Pfizer-BioNTech y Moderna demostraron la eficacia de usar nanopartículas lipídicas (NPL) para administrar el ARNm en las células objetivo. A finales de 2019, impulsadas por la epidemia de SARS-CoV-2, tanto la literatura publicada como las solicitudes de patentes relacionadas con las terapias de ARNm experimentaron un rápido aumento en todo el mundo. Después de 2020, el número de artículos publicados mostró una tendencia de crecimiento rápido y llegó a 3361 en 2021 y a casi 5000 en 2022. El número de solicitudes de patentes mantuvo la tendencia ascendente hasta 2020 y llegó a 382 en 2021. Se estima que en 2022 habrá aumentado hasta 510 (figura 1).
El éxito de la vacuna de ARNm contra la COVID-19 ha revelado el potencial del uso la plataforma de ARNm no solo para otras enfermedades infecciosas, sino también para el tratamiento del cáncer. Dado que la información derivada de los estudios sobre virus puede servir como base del trabajo sobre las vacunas contra el cáncer, parece que se ha cerrado el círculo.
El sistema inmunitario entra en acción: cómo funcionan las vacunas de ARNm contra el cáncer
Las aplicaciones del ARNm en las vacunas contra el cáncer son amplias, y los investigadores están explorando varias estrategias para la inmunoterapia contra esta enfermedad:
- Presentación de antígenos: las vacunas de ARNm administran antígenos del cáncer a las células presentadoras de antígenos para la presentación del complejo mayor de histocompatibilidad de clase I y II.
- Función adyuvante: el ARNm estimula la activación inmunitaria uniéndose a receptores de reconocimiento de patrones expresados por células presentadoras de antígenos.
- Receptores de antígenos: el ARNm introduce receptores de antígenos, como los receptores de antígeno quimérico (CAR) y los receptores de linfocitos T, en los linfocitos.
- Producción de proteínas: el ARNm permite la expresión de proteínas inmunomoduladoras, incluidos los receptores de tipo Toll, los receptores de quimiocinas, los ligandos coestimuladores, las citocinas, las quimiocinas y diferentes formatos de anticuerpos monoclonales en diversos subconjuntos de células.
¿Estamos cerca de contar con terapias de ARNm contra el cáncer?
Compañías como Genentech, CureVac y Moderna están desarrollando vacunas de ARNm con neoepítopos que pueden generar respuestas inmunitarias contra los tumores que se desea combatir. Existen docenas de ensayos clínicos que están probando las vacunas de ARNm como monoterapias o como parte de politerapias en personas con varios tipos de cáncer, incluidos el pancreático, el colorrectal y el melanoma. Varios candidatos han llegado a la fase 2 de los ensayos, que han demostrado una eficacia favorable en melanomas, carcinomas amicrocíticos de pulmón y cáncer de próstata (tabla 1).
Tabla 1. Vacunas de ARNm en ensayos clínicos contra el cáncer (fase 2 y posteriores)
| Nombre de la vacuna |
CAS Registry Number® |
Indicación terapéutica |
Antígeno | Compañía |
| Autogene cevumeran | 2365453-34-3 | Melanoma; cáncer colorrectal |
Neoantígenos específicos del paciente |
BioNTech |
| mRNA 4157 | 2741858-84-2 | Melanoma | Hasta 34 neoantígenos | Moderna |
| BNT 113 | 2882951-85-9 | Carcinoma de células escamosas de cabeza y cuello PV16+ | Antígenos tumorales derivados de VPH16 (oncoproteína E6 y E7) | BioNTech |
| CV 9202 | 1665299-76-2 | Carcinomas amicrocíticos de pulmón | NY-ESO-1, MAGE C1, MAGE C2, TPBG (5T4), survivina, MUC1 | CureVac |
| CV 9103 | 2882951-83-7 | Cáncer de próstata | Combinación de cuatro antígenos asociados con el cáncer de próstata | CureVac |
| SW 1115C3 | 2882951-82-6 | Carcinomas amicrocíticos de pulmón; cáncer de esófago | Neoantígenos específicos del paciente | Stemirna Therapeutics |
| BNT 111 | 2755828-88-5 | Melanoma | Combinación de cuatro antígenos asociados con el melanoma | BioNTech |
Aunque las vacunas de ARNm contra el cáncer están despertando el interés de la comunidad investigadora, la mayor parte de la investigación oncológica se ha centrado tradicionalmente en las terapias de ARNm, y hay una amplia variedad de candidatos que han entrado en la fase de desarrollo clínico (tabla 2), entre ellos:
- TriMix-MEL (eTheRNA Immunotherapies), una combinación de tres ARNm que activan células inmunitarias esenciales contra el cáncer.
- Una terapia de ARNm (BioNTech) que codifica un anticuerpo monoclonal que actúa sobre la claudina 18, una proteína que se expresa en varios tipos de cáncer.
- Un ARNm encapsulado en NPL (MedImmune LLC) administrado mediante inyección intratumoral que se ha diseñado para aumentar la producción local de interleucina-12 (IL-12) e inducir una respuesta inmunitaria antitumoral.
Tabla 2. Productos terapéuticos de ARNm en ensayos clínicos contra el cáncer
| Nombre del fármaco de ARNm | Número de registro de CAS | Indicación terapéutica | Compañía |
| TriMix-MEL; ECL-006; E011-MEL | 2877674-59-2 | Melanoma | eTheRNA Immunotherapies |
| BioNTech-1; BNT 141; BNT-141; BNT141 | 2877707-22-5 | Tumores sólidos | BioNTech |
| BNT-142; BNT142 | 2877707-34-9 | Tumores sólidos | BioNTech |
| BNT-151; BNT151 | 2877709-82-3 | Tumores sólidos | BioNTech |
| BNT 152; BNT152 | 2877709-92-5 | Tumores sólidos | BioNTech |
| BNT 153; BNT153 | 2877709-93-6 | Tumores sólidos | BioNTech |
| MEDI1191; MEDI-1191 | 2877712-03-1 | Tumores sólidos | Moderna |
| mRNA-2752 | 2878461-50-6 | Tumores sólidos | Moderna |
| SAR-441000 | 2879301-17-2 | Tumores sólidos | Sanofi, BioNTech |
| SQZ-eAPC-HPV | 2879306-51-9 | VPH y tumores sólidos | SQZ Biotechnologies |
Las vacunas del ARNm contra el cáncer, cada vez más cerca
En los últimos años, ha habido importantes avances en la tecnología empleada en la lucha contra el cáncer, pero siguen existiendo algunos retos fundamentales. En primer lugar, las vacunas de ARNm contra el cáncer necesitan sistemas de envasado y administración específicos que tengan una afinidad adecuada con el órgano o el tejido en el que deben actuar. Actualmente, los investigadores están evaluando estrategias que faciliten estos aspectos, por ejemplo, mediante la conjugación de restos que actúen sobre órganos concretos con nucleótidos. Aunque las NPL son los vehículos más estudiados para la administración de ARNm, su aplicación clínica se ha visto obstaculizada por los problemas de citotoxicidad y por su tiempo de circulación, relativamente corto. Por este motivo, se están evaluando varios sistemas de administración alternativos (p. ej., exosomas) para mejorar la biodisponibilidad, la carga y la liberación de la carga de ARNm.
Una correcta administración de la carga de ARNm no es suficiente. Para maximizar la eficacia, los investigadores están estudiando estrategias que potencien la expresión de las proteínas in vivo. Todas las partes del ARNm —la caperuza y las regiones 5′ y 3′, el marco abierto de lectura y la cola poliadenilada— se pueden optimizar para incrementar la expresión de las proteínas. Los nucleósidos modificados químicamente han presentado resultados prometedores en esta área.
Además de la cantidad de expresión proteínica, un obstáculo crucial de las vacunas de ARNm es el periodo relativamente corto de producción de proteínas, que obliga a repetir la administración. Se están explorando los ARNm circulares y autoamplificados como estrategias para prolongar la vida útil del ARN y aumentar la producción total de proteínas.
Aunque todavía queda un largo camino por delante, las vacunas de ARNm son una opción clínica versátil para tratar varios tipos de cáncer, ya sea por sí solas o en combinación con otras opciones terapéuticas, como los inhibidores de puntos de control. Mientras esperamos que las primeras terapias de ARNm lleguen al mercado, será interesante explorar los resultados de las numerosas estrategias innovadoras diseñadas para avanzar en la lucha global contra el cáncer.
Si desea obtener más información sobre las vacunas y terapias de ARNm, lea nuestro artículo revisado por pares publicado en ACS Pharmacology and Translational Science.