Gain new perspectives for faster progress directly to your inbox.

グローバル規模で増大するがんの負担
がんとそれに関連する死亡率の負担は、人口の高齢化と、がんの主要危険因子の有病率と分布の変化によって、世界中で急速に増大しています。 2040年には2,840万人ががんと診断されると予測されています。これは、2020年から47%の上昇となります。
最も診断数が多いがんは、現在は肺がんを抜いて女性の乳がんになっています。推定では2020年には230万人(11.7%)が新たに乳がんに罹患するとされており、次いで肺がん(11.4%)、大腸がん(10.0%)、前立腺がん(7.3%)、胃がん(5.6%)となっています。 がん治療における重要な進歩のひとつとして、チェックポイント阻害薬などの免疫療法があります。 この画期的な前進にもかかわらず、免疫療法はすべてのがんに効く万能薬となっていません。 これは、すべての腫瘍タイプが免疫療法の薬に反応するわけではないためです。それに、対抗機構が腫瘍の免疫回避や増殖につながる可能性すらあります。
現在、米国食品医薬品局によって承認されているmRNAがんワクチンは現在ありません。しかし、チェックポイント阻害薬ペムブロリズマブ(メルク社)との組み合わせにおける治験用ワクチンmRNA-4157-P201(モデルナ社)は、完全切除後の高リスク黒色腫における補助療法として画期的治療薬に指定されました。 mRNA ワクチンがCOVID-19で成功したことから、研究者はmRNAワクチン技術ががん細胞の治療に応用できると確信しています。 では、がん治療にmRNA療法が取り入れられる日は近いのでしょうか。
一巡したmRNAワクチンとがんの関係
多くの人にとって、COVID-19 mRNAワクチンは一夜にして開発されたもののように見えるかもしれません。 しかし、これらワクチンの迅速な設計、製造、そしてテストは、インフルエンザやサイトメガロウイルス、そしてジカ熱用のワクチンといった基盤となる長年の研究がなければ不可能でした。
1995年、画期的な研究によって、カルチノ胚性抗原をコードするnaked RNAを筋肉内に注射すると、マウスに抗原特異的抗体反応が誘発されることが示されました。 その翌年には別の研究で、mRNAを導入した樹状細胞を腫瘍を持つマウスに注射すると、T細胞免疫反応が誘導され、腫瘍の成長が抑制されることが示されたのです。 この研究が、mRNAをベースとした技術の実現可能性、有効性、安全性を探求する数多くの研究へ道筋をつけました。 しかしながら、最近までは、その不安定性、自然免疫原性、非効率的な生体内送達などが原因で、mRNAワクチンや治療への応用は限られていました。 研究者たちが直面した大きな課題は、mRNAをどのようにして必要な場所に届けるかということでした。mRNA配列を何らかの形で保護せずに体内に注入すれば、異物として認識され破壊されてしまうだけです。
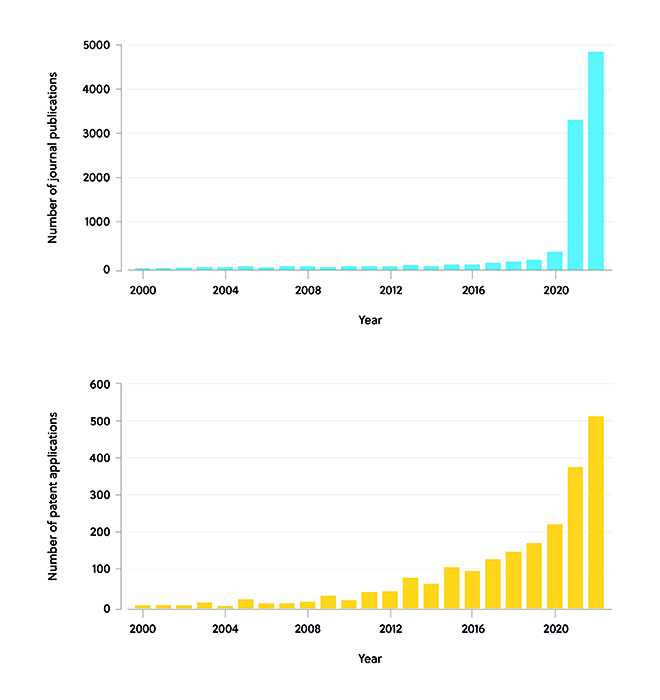
そんな中、新型コロナウイルスSARS-CoV-2に対応するために行われたmRNAワクチンの急速な開発のお陰で、mRNAワクチンの使用は研究室から病室へと加速されます。 例えば、ファイザー/ビオンテック社とモデルナ社のワクチンは、mRNAを標的細胞に送達する上で脂質ナノ粒子(LNP)の利用が有効であることを実証しました。 2019年末、SARS-CoV-2の流行を受け、両社ともmRNA治療に関する論文を発表、すると関連特許出願が世界中で急速に増加しました。 2020年以降は、論文数は急速な増加傾向を示し、2021年には3,361件、2022年には5,000件近くにまで増加しています。 特許出願件数も2020年以降ずっと増加傾向が続き、2021年に382件に達しているほか、2022年には510件に増加すると推定されています(図1)。
COVID-19 mRNAワクチンが成功したことで、mRNAプラットフォームが他の感染症だけでなく、がんにも拡大できる可能性が明らかになりました。 さまざまなウイルス研究から得られた洞察が、今やがんワクチンの研究に役立つ可能性が出てきています。つまり一周して、出発点に戻ってたきたと言うわけです。
免疫系をリクルートする - mRNAがんワクチンの仕組み
がんワクチンにおけるmRNAの応用範囲は広く、そこで研究者はがん免疫療法に向けて以下を含むいくつかの戦略を模索しています。
- 抗原提示。 mRNAワクチンは、がん抗原を抗原提示細胞(APC)に送達し、主要組織適合性複合体クラスIおよびクラスIIを提示します。
- アジュバント機能。 mRNAは、APCにより発現するパターン認識受容体に結合することで免疫活性化を刺激します。
- 抗原受容体。 mRNAは、キメラ抗原受容体(CAR)やT細胞受容体などの抗原受容体をリンパ球に導入します。
- タンパク質の生産。 mRNAは、トール様受容体、ケモカイン受容体、共刺激性リガンド、サイトカイン、ケモカイン、そしてさまざまなモノクローナル抗体などの免疫調節タンパク質を、各種細胞サブセットに発現させることができます。
mRNAがん治療は間もなく実現するのか
ジェネンテック社、CureVac社、そしてモデルナ社などの企業は、標的腫瘍に対する免疫反応を誘発できるネオエピトープをコード化したmRNAワクチンを開発しています。 mRNAワクチンは、単剤療法としてまたは併用療法の一環として用いる形で、膵臓がん、大腸がん、黒色腫などさまざまなタイプのがん患者を対象に数十件の臨床試験が実施されています。 いくつかの候補薬で第2相臨床試験が始まっており、黒色腫、非小細胞肺癌、そして前立腺癌で良好な有効性が示されています(表1)。
表1. がんの臨床試験中のmRNAワクチン(第2相以降)
| ワクチン 名 |
CAS 登録 番号® |
対象 疾患 |
抗原 | 企業 |
| Autogene cevumeran | 2365453-34-3 | 黒色腫、 大腸 がん |
患者特異的な 新抗原 |
ビオンテック |
| mRNA 4157 | 2741858-84-2 | 黒色腫 | 最大34の新抗原 | モデルナ |
| BNT 113 | 2882951-85-9 | PV16+頭頸部扁平上皮がん | HPV16由来の腫瘍抗原(がんタンパクE6およびE7) | ビオンテック |
| CV 9202 | 1665299-76-2 | 非小細胞肺がん | NY-ESO-1、MAGE C1、MAGE C2、TPBG(5T4)、サバイビン、MUC1 | CureVac |
| CV 9103 | 2882951-83-7 | 前立腺がん | 前立腺がん関連抗原4種類の混合 | CureVac |
| SW 1115C3 | 2882951-82-6 | 非小細胞肺がん、食道がん | 患者特異的な新抗原 | Stemirna Therapeutics |
| BNT 111 | 2755828-88-5 | 黒色腫 | 黒色腫関連抗原4種類の混合 | ビオンテック |
mRNAがんワクチンが研究者間で関心を集めている一方で、歴史的にはほとんどのがん研究はmRNA治療法に焦点を当ててきており、現在でも以下を含む、多岐にわたる候補薬が臨床開発段階にあります(表2)。
- TriMix-MEL、(eTheRNA Immunotherapies社)。がんに対する主要免疫細胞を活性化するmRNAを3種混合したもの。
- mRNA治療薬、(ビオンテック社)。複数のがんに発現するタンパク質のクローディン18を標的とするモノクローナル抗体をコードするもの。
- LNPでカプセル化されたmRNA、(MedImmune LLC社)。腫瘍内注射で投与することで局所的にインターロイキン12(IL-12)産生を促し、抗腫瘍免疫を誘導するように設計されている。
表2. がんの臨床試験中のmRNA治療薬
| mRNA薬剤名 | CAS 登録番号 | 対象疾患 | 企業 |
| TriMix-MEL、ECL-006、E011-MEL | 2877674-59-2 | 黒色腫 | eTheRNA Immunotherapies |
| BioNTech-1、BNT 141、BNT-141、BNT141 | 2877707-22-5 | 固形腫瘍 | ビオンテック |
| BNT-142、BNT142 | 2877707-34-9 | 固形腫瘍 | ビオンテック |
| BNT-151、BNT151 | 2877709-82-3 | 固形腫瘍 | ビオンテック |
| BNT 152、BNT152 | 2877709-92-5 | 固形腫瘍 | ビオンテック |
| BNT 153、BNT153 | 2877709-93-6 | 固形腫瘍 | ビオンテック |
| MEDI1191、MEDI-1191 | 2877712-03-1 | 固形腫瘍 | モデルナ |
| mRNA-2752 | 2878461-50-6 | 固形腫瘍 | モデルナ |
| SAR-441000 | 2879301-17-2 | 固形腫瘍 | Sanofi、 ビオンテック |
| SQZ-eAPC-HPV | 2879306-51-9 | HPVおよび固形腫瘍 | SQZ Biotechnologies |
mRNAがんワクチンの実現に向けて
近年、mRNAがん技術は大きな進歩を遂げました。しかし根本的な課題がいくつか残っています。 まずmRNAがんワクチンは、標的組織/臓器に適切な親和性を持つ専用のパッケージングと送達システムを必要とするということがあります。 研究者は現在、これに対してはオリゴヌクレオチドに臓器の標的部位を結合させるなど、さまざまな手段を検討しています。 mRNA送達で最も研究されている媒体はLNPです。しかし細胞毒性の懸念と循環時間が比較的短いことから臨床応用が妨げられてきました。 そのため、mRNAカーゴのバイオアベイラビリティ、負荷、放出を改善するために、さまざまな代替スマート送達システム(エクソソームなど)が検討されています。
ただし、mRNAカーゴ送達の成功だけでは不十分です。 最大限の効果を得るため、生体内でタンパク質発現を高める手法も研究されてきました。 mRNAのすべての部分(キャップ、5′領域、3′領域、オープンリーディングフレーム、ポリアデニル化テール)が、タンパク質発現増強のために最適化できます。 そしてこの領域では、化学修飾ヌクレオシドが有望になっています。
タンパク質の発現量に加えて、mRNAワクチンの重大な課題として、タンパク質の産生期間が比較的短く、反復投与が必要なことが挙げられます。 RNAの寿命を延ばし、タンパク質の全収率を上げる戦略として、自己増幅型や環状のmRNAが研究されています。
まだ多くの課題が残されているものの、mRNAワクチンは、単独またはチェックポイント阻害剤など既存の治療オプションと併用することで、何種類かのがんの治療のための汎用性の高い臨床オプションとなっています。 最初のmRNA治療薬の発表が期待される一方、がんというグローバル規模の負担に取り組む中で、多数の革新的な戦略から生み出されてくる成果自体も、注目に値します。
mRNAワクチンと治療薬についての詳細は、ACS Pharmacology and Translational Science誌に掲載された弊社の査読付き論文をお読みください。