Gain new perspectives for faster progress directly to your inbox.

Como uma classe de terapias, os inibidores covalentes vêm ganhando popularidade nos últimos anos, com a aprovação, pela Food and Drug Administration (FDA) dos EUA, de uma série de medicamentos covalentes em diversas indicações, principalmente focados na terapia do câncer. Seu mecanismo de ação único oferece diversas vantagens sobre os inibidores não covalentes mais comuns, tornando-os um caminho promissor para o desenvolvimento de terapias.
Historicamente, os pesquisadores têm evitado investigar inibidores covalentes devido a preocupações de segurança e desafios com seu projeto e fabricação. Mas, a maré está mudando.
O CAS identificou mais de 10.000 artigos científicos que discutem um subconjunto de inibidores covalentes desde 2000. Marcadamente, os esforços de pesquisa intensificaram-se na última década, sendo que as publicações em periódicos quadruplicaram desde 2010 (Figura 1).
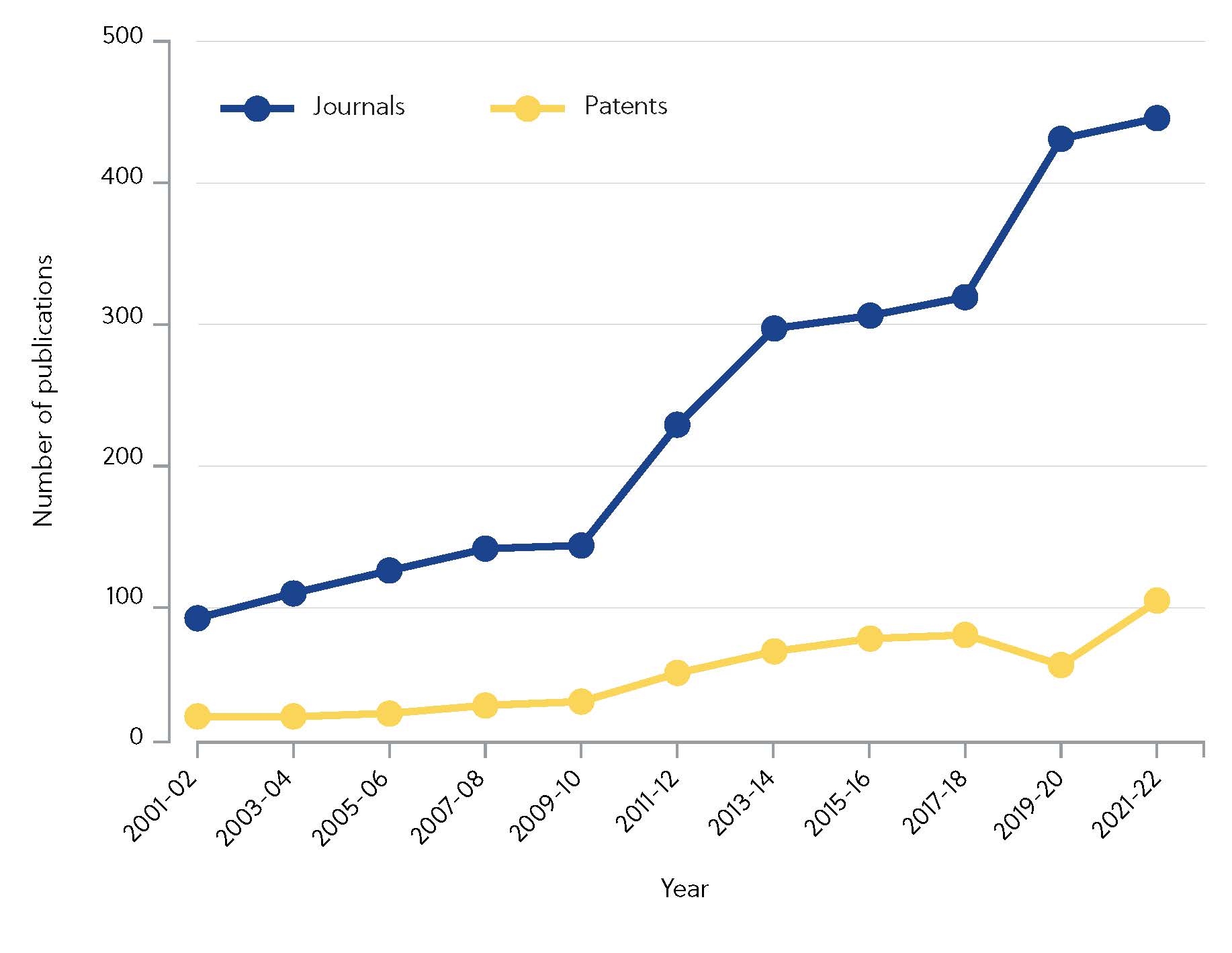
O investimento está valendo a pena, os medicamentos covalentes de grande sucesso ibrutinibe e osimertinibe geraram um total de vendas de US$ 4,33 bilhões em 2020. A questão permanece: o que são exatamente os inibidores covalentes e por que as empresas e laboratórios acadêmicos começaram a favorecê-los em detrimento dos inibidores não covalentes?
Como o próprio nome sugere, inibidores covalentes formam uma ligação covalente com as proteínas-alvo, geralmente modificando-as de forma irreversível. Ao contrário dos inibidores não covalentes, que se ligam de forma reversível, os inibidores covalentes criam uma ligação duradoura com o seu alvo, levando a uma maior potência e a uma duração de ação mais prolongada. Isso tem vantagens e desvantagens.
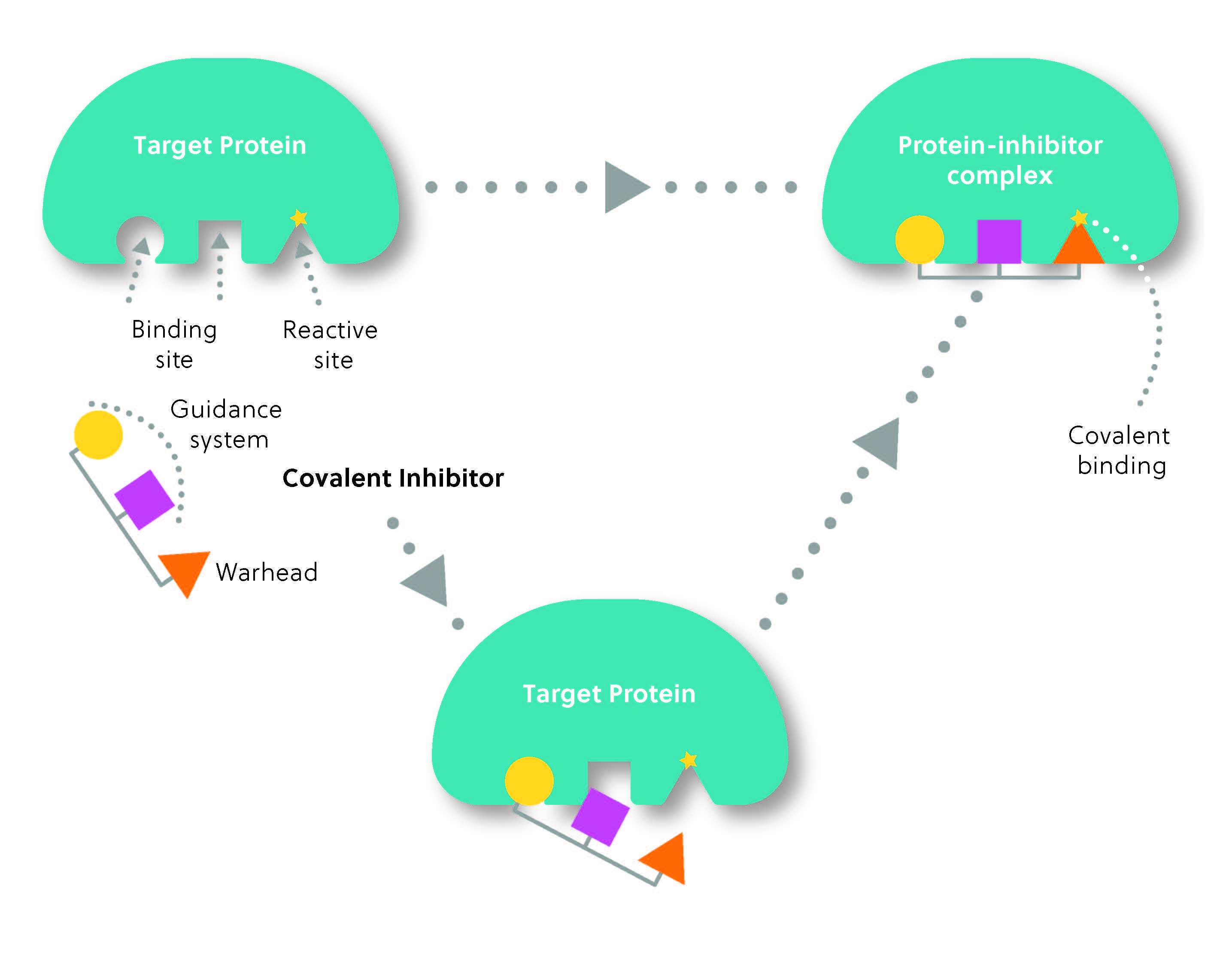
Normalmente, a estrutura de um inibidor covalente é composta de duas partes: o grupo reativo ou “warhead”, que forma a ligação covalente com o alvo, e o “sistema de orientação”, que determina a seletividade do inibidor para o alvo (Figura 2). Pense nisso como um míssil direcionado pelo calor: o sistema de orientação localiza o alvo, enquanto o warhead “dá o golpe” para formar a ligação covalente.
Os inibidores covalentes não são uma inovação recente. Na verdade, eles têm sido usados para tratar doenças há mais de um século, sendo a penicilina um dos primeiros exemplos. Os antibióticos à base de penicilina ligam-se de forma covalente à enzima alvo, inibindo assim a síntese da parede celular bacteriana e levando à ruptura da membrana celular. Outro exemplo bem conhecido é a aspirina, que acetila irreversivelmente uma enzima chave envolvida na produção de mediadores inflamatórios. Curiosamente, a descoberta de que estes medicamentos atuam por mecanismos covalentes foi feita depois de seu uso já estar disseminado. Na verdade, muitos dos principais medicamentos inibidores covalentes foram descobertos por acaso, e não como resultado de projetos racionais de medicamento.
Vantagens dos inibidores covalentes
São imensas as vantagens em potencial dos inibidores covalentes. Enquanto os inibidores não covalentes se associam e se dissociam livremente das enzimas, os inibidores covalentes formam ligações fortes e duradouras com seu alvo. Isto significa que podem interromper eficazmente a atividade da proteína-alvo durante um período prolongado, levando a efeitos terapêuticos mais sustentados. Esta potência aumentada significa que os medicamentos podem ser administrados em doses mais baixas e com menor frequência, o que reduz os possíveis o risco de efeitos secundários, aumenta a adesão e diminui os custos do tratamento.
Além disso, os inibidores covalentes apresentam uma seletividade notável, atingindo com precisão os alvos pretendidos. Esta propriedade permite-lhes atingir proteínas desafiadoras que seriam difíceis para inibidores não covalentes, tais como as sem bolsão de ligação convencional. De facto, alvos anteriormente vistos como “não passíveis de tratamento”, como KRAS (o oncogene que apresenta mutação com maior frequência), agora podem ser um alvo de sucesso com o uso de inibidores covalentes. A aprovação do primeiro inibidor de KRAS, o sotorasibe, representou um marco significativo no tratamento de cânceres difíceis de tratar.
Desvantagens dos inibidores covalentes
Diversas propriedades que tornam os inibidores covalentes uma terapia promissora também podem criar desafios no desenvolvimento de medicamentos. A irreversibilidade da ligação exige que qualquer ligação seja seletiva. No entanto, se o warhead não for seletivo o suficiente, o medicamento pode ligar-se a proteínas não desejadas, resultando em efeitos fora do alvo que podem causar danos a longo prazo. Além disso, algumas proteínas-alvo podem sofrer mutação ou sofrer alterações estruturais que impedem o inibidor covalente de se ligar a elas e inibi-las com eficácia. Isto pode levar ao desenvolvimento de resistência e reduzir a eficácia do medicamento a longo prazo.
Devido a estes desafios, a concepção de inibidores covalentes requer uma ponderação cuidadosa de vários fatores, incluindo a reatividade do warhead, a especificidade do local de ligação e a estabilidade da ligação covalente formada. Os grupos reativos devem seguir o “princípio Cachinhos Dourados” – devem ser reativos o suficiente para formar uma ligação com um alvo após a formação do complexo, mas não reativos o suficiente para formar ligações com outros alvos proteicos ou grupos funcionais quando não ligados. Alcançar o equilíbrio certo entre esses fatores pode ser complexo e demorado.
O aumento das terapias de inibidor covalente
Os avanços na tecnologia têm desempenhado um papel crucial na aceleração do desenvolvimento de inibidores covalentes. Um ponto de inflexão fundamental neste campo ocorreu quando os pesquisadores começaram a se concentrar na covalência desde o início do desenvolvimento, em vez de descobrirem o mecanismo incidentalmente.
Os pesquisadores utilizaram duas abordagens principais para criar terapias inibidoras covalentes eficazes: priorizar o ligante e priorizar o eletrófilo. As abordagens que priorizam o ligante envolvem projetar pequenas moléculas que podem reagir com resíduos de aminoácidos específicos na proteína-alvo. Por outro lado, as abordagens eletrofílicas concentram-se na parte do warhead do medicamento, identificando grupos eletrofílicos reativos que podem formar ligações covalentes com resíduos nucleofílicos na proteína-alvo.
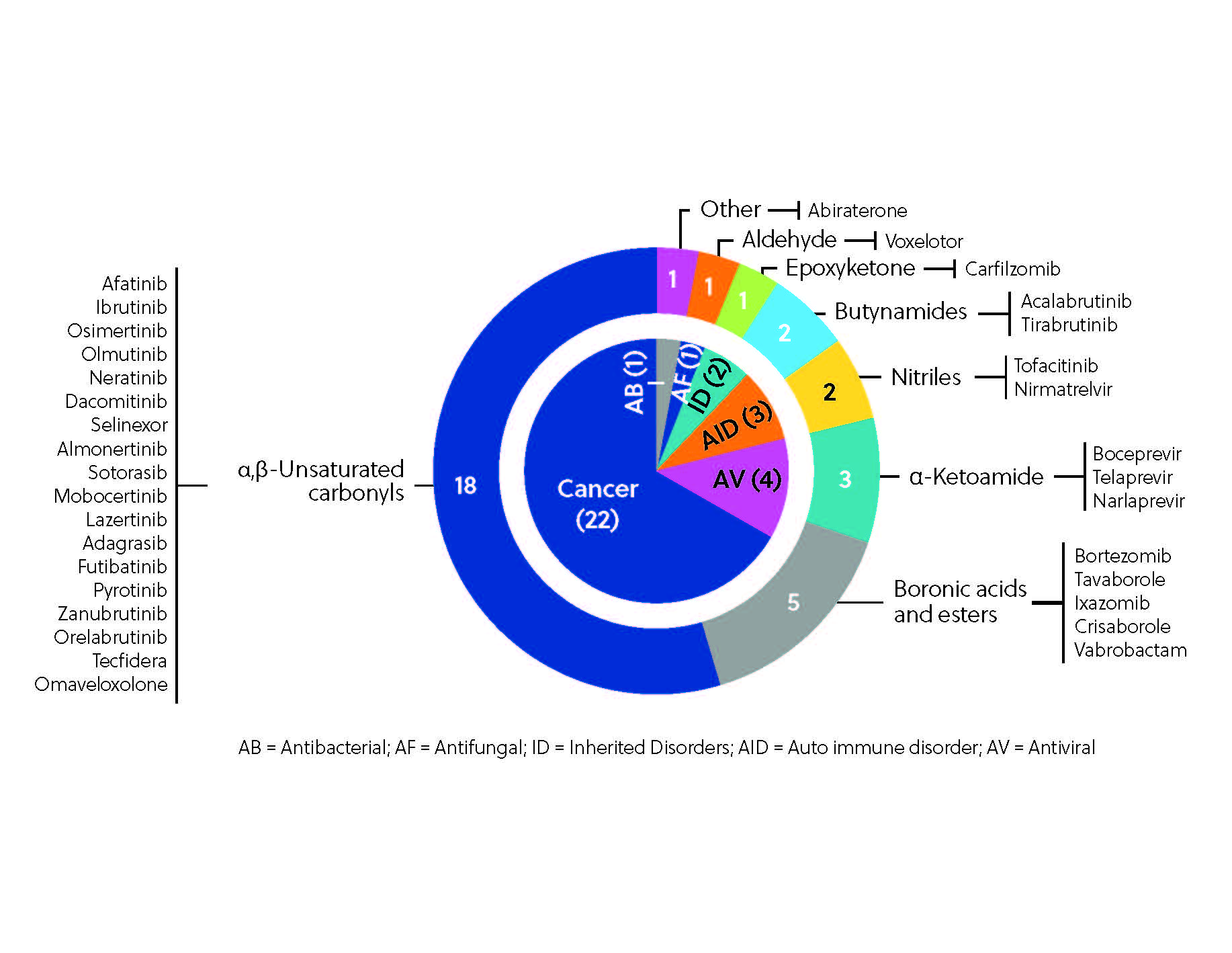
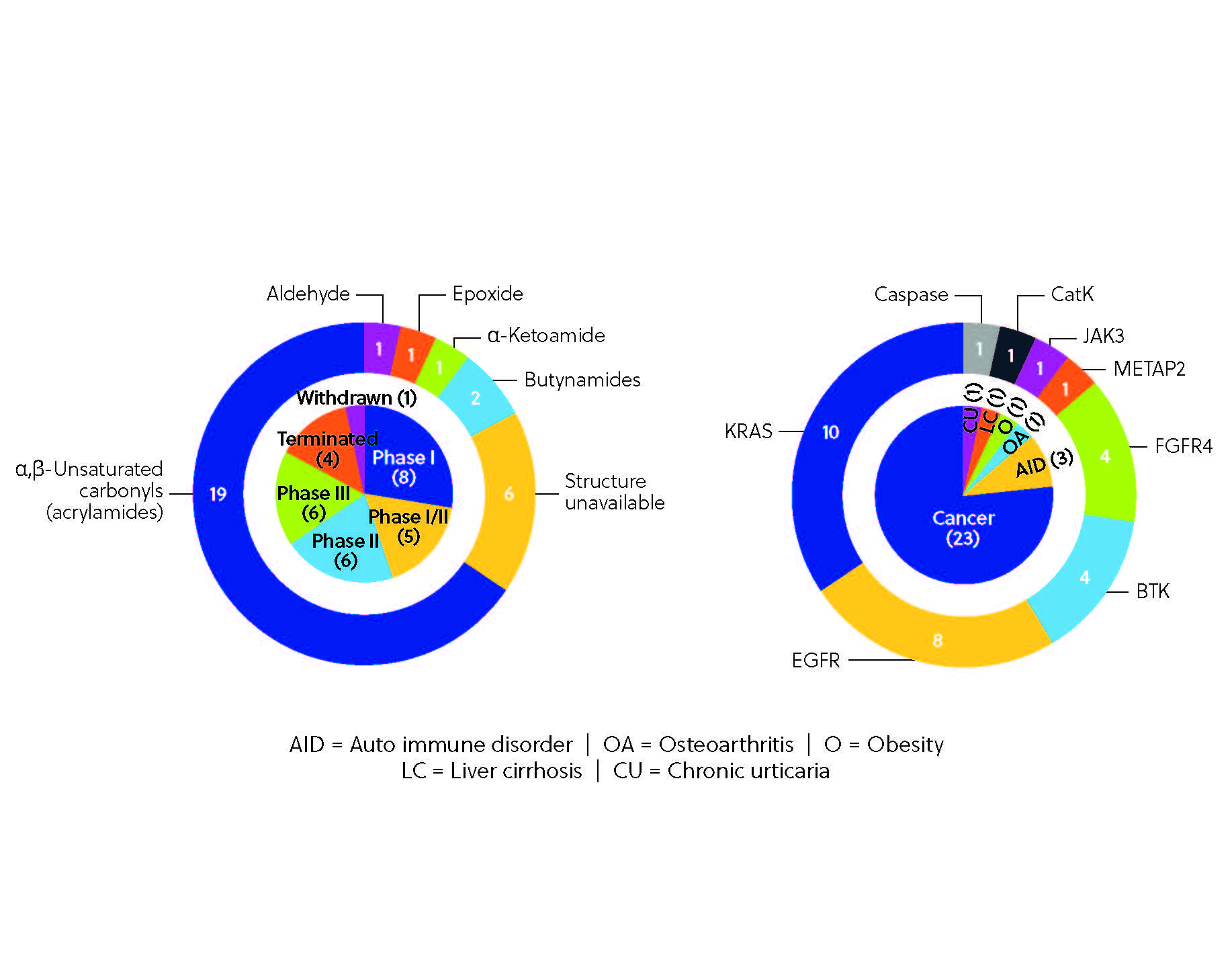
Até o momento, mais de 30 inibidores covalentes em todo o mundo receberam aprovação regulamentar como terapia (Figura 3), sendo que o mais marcante, o já mencionado ibrutinibe, que atingiu o top 10 nas vendas mundiais de medicamentos em 2021. O ibrutinibe é um dos vários inibidores de quinase notáveis descobertos pelas abordagens que priorizam o ligante, ao lado do afatinibe, dacomitinibe e neratinibe.
Outra aplicação promissora dos inibidores covalentes é a sua capacidade de inibir proteases virais. O nirmatrelvir (em combinação com ritonavir), um inibidor covalente reversível do SARS-CoV-2 MPRO, aprovado para uso pelo FDA no tratamento da COVID-19, fornece uma opção de tratamento oral muito necessária para pacientes vulneráveis. O nirmatrelvir foi desenvolvido através de uma abordagem de priorizar o eletrófilo, pela adaptação estruturalmente guiada de um inibidor covalente estudado previamente.
O que está por vir em relação aos inibidores covalentes?
O pipeline do desenvolvimento clínico de inibidores covalentes está repleto possibilidades. Vários inibidores covalentes estão atualmente em ensaios clínicos (Figura 4), incluindo o remibrutinibe, inibidor de BTK, o nazartinibe, EGFR-TKI de terceira geração e o roblitinibe, inibidor seletivo de FGFR4. O pipeline é diversificado, com múltiplas proteínas-alvo de diferentes áreas terapêuticas, desde doenças autoimunes, como artrite reumatoide e alopecia areata, a outras doenças, como obesidade e osteoartrite, embora as terapias contra o câncer ainda dominem o pipeline. Esta variedade é uma prova do enorme potencial da inibição covalente, possibilitada por ferramentas e técnicas emergentes, incluindo sofisticadas plataformas de rastreio e descobertas possibilitadas pela quimioproteômica. São tecnologias que permitem aos pesquisadores rastrearem vastas bibliotecas de compostos e visualizar diretamente as interações covalentes dentro do proteoma. Podemos esperar inibidores covalentes ainda mais precisos e potentes com essas inovações.
O aumento dos inibidores covalentes marca um ponto de inflexão no desenvolvimento de medicamentos. Sua capacidade de formar ligações duradouras com proteínas-alvo, aliada aos avanços tecnológicos, abriu o caminho para uma nova era de terapias. À medida que a pesquisa neste campo continua a florescer, os inibidores covalentes detêm uma grande promessa na revolução do tratamento de várias doenças e na melhoria da vida dos pacientes. Para saber mais sobre inibidores covalentes e ouvir a opinião dos especialistas sobre as principais tendências a serem observadas, assista ao nosso webinar ou leia mais em nossa publicação recente no ChemRXiV.Para tópicos adicionais relacionados ao câncer, explore nossa análise aprofundada do cenário dos inibidores de RAS ou saiba mais sobre degradação de proteínas-alvo e colas moleculares.