2021年12月の時点で、2019年に発生した新型コロナウイルス感染症(COVID-19)の対策として80億回以上のワクチンが投与されています。これには、約2億1700万回のブースター接種(追加接種)が含まれています。 このワクチンの主な標的は、いわゆる「スパイク」タンパク質または「S」タンパク質です。これは、宿主細胞へのウイルス侵入を許す重要な役割を果たしている、必須ウイルスタンパク質です。
ワクチンは重要ですが、COVID-19の治療法の開発により、天然変性タンパク質が重要な病理学的役割を果たしている可能性があることが明らかになりました。 歴史的には、各タンパク質のアミノ酸配列がその三次元構造を決定し、そしてその構造が今度はその機能を決定すると生物学者は考えていました。 ところが、固定された、もしくは整った三次元構造を欠くにもかかわらず、基幹的な生物活動を呈するタンパク質や領域の大きいグループがあります。いわゆる天然変性タンパク質および領域です(図1)。
このタンパク質のディスオーダーはアミノ酸配列に符号化されており、すべての生物やウイルスに豊富に存在しています。 SARS-CoV-2タンパク質内のこれら注目すべき領域の特性をより深く理解することで、COVID-19の治療法の開発をより迅速に進めることができる可能性があります。
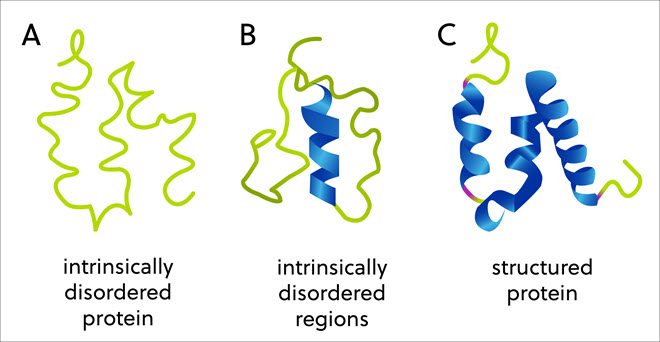
天然変性タンパク質の例
タンパク質内の「天然変性タンパク質」(IDP)または「天然変性タンパク質領域」(IDPR)に見られる天然のばらつきは、生物の3つの界すべてで見られます。 それらは、酵素触媒作用、アロステリック調節、細胞シグナル伝達、転写などの重要なプロセスに関与しています。
ただ、神経変性や糖尿病、心血管疾患、アミロイド症、遺伝性疾患、および癌などの疾患においても役割を果たしています。 さらに、しばしばウイルスタンパク質にもそういった領域が含まれており、それは宿主タンパク質に容易かつ無差別的に結合する能力をウイルスタンパク質に与えているため、病原性と相関関係が指摘されています。
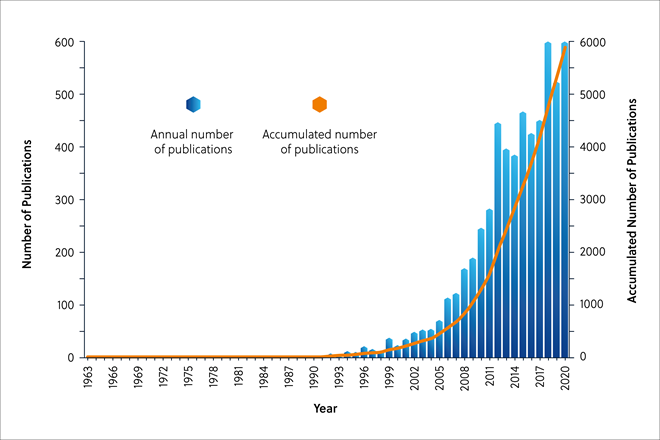
CAS コンテンツのコレクションTM(図2)での検索で示されるように、タンパク質科学におけるIDP/IDPRへの関心は、2000年以降急速に高まっており、COVID-19を含む薬剤設計における役割も研究され始めています。
SARS-CoV-2内の天然変性タンパク質
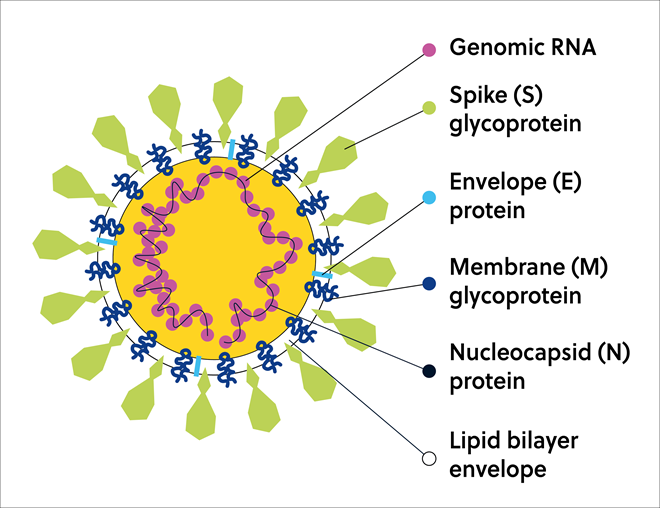
SARS-CoV-2は、そのゲノムRNAと共に、以下で構成される粒子に束ねられてビリオンを形成します。宿主細胞への侵入に重要なSタンパク質、ウイルスの結合を促進する膜(M)タンパク質、イオンチャネル小エンベロープの(E)タンパク質、そしてウイルスRNAと結合してヌクレオカプシドを形成するヌクレオカプシド(N)タンパク質(図3)。
IDP/IDPRはSARS-CoV-2プロテオームでは一般的ではありません。 実際のところ、SARS-CoV-2プロテオームは、かなりのレベルの構造的秩序を示しています。SARS-CoV-2タンパク質は、ヌクレオカプシド(N)タンパク質を除き、少々の天然変性タンパク質領域を含んでいるだけの、高度に秩序のあるタンパク質です。 ただし、注目に値するのは、既存のディスオーダー領域は、ウイルスの機能と毒性に多大な影響を与えているため、抗ウイルス薬発見の有望な創薬ターゲットであるということです。 このようなアプローチは、新しい候補薬の特定に役立つこともすでに証明されています。
ヌクレオカプシド(N)タンパク質
RNAに結合するNタンパク質は、ウイルス粒子内のゲノムRNAを安定化し、ウイルスゲノムの転写、複製、およびパッケージングを制御します。 Nタンパク質は高度にディスオーダーしており、予測される天然ディスオーダーの平均パーセンテージは約65%になっています。 これらのディスオーダー領域は、ヌクレオカプシドを維持する上で重要なようであるため、製剤設計の標的として役立つ可能性があります。 Nタンパク質内のディスオーダー領域は、「液-液相分離」と呼ばれるプロセスを介してタンパク質を凝集させる上でも重要であるようです。これは、宿主細胞の免疫において重要dであるストレス顆粒の自然な形成を阻害する方法となっている可能性があります。 従って、Nタンパク質の液-液相分離プロセスの崩壊は抗ウイルス介入が期待でき、またCOVID-19に対抗する薬剤開発に向けた新たな標的と戦略を提供します。
スパイク(S)タンパク質
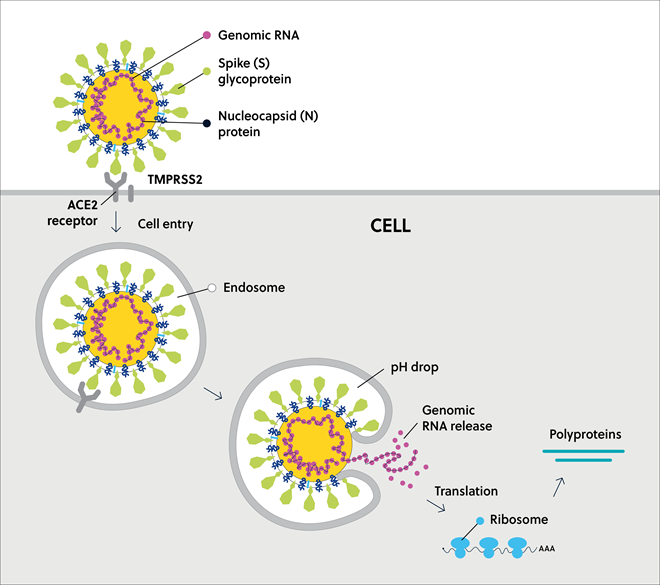
Sタンパク質はウイルス表面を冠のように装飾します。 ウイルスが宿主細胞に侵入する上で重要な役割を担うため(図4)、COVID-19ワクチンの開発において一般的に使用される薬剤標的となっています。 感染の初期段階である受容体結合と膜融合は、どちらも広範囲な天然変性領域に関連しています。
Sタンパク質の解析では、S成熟に関連するSサブユニット切断部位とS融合ペプチドがともにIDPRに関連していることを示しています。 構造化タンパク質領域と比較して、非構造化タンパク質ではタンパク分解が大幅に速く進むことを考えると、SARS-CoV-2Sタンパク質のこの構造的特異性は機能的に非常に重要である可能性があります。
SARS-CoV-2ウイルスに感染中は、スパイクタンパク質と、ウイルスが結合するヒト組織の受容体であるACE2受容体との界面でIDPRが検出できます。 スパイクタンパク質の主な残基は、ACE2に対して強い結合親和性があり、これがSARS-CoV-2の高い感染力の理由のひとつと考えられます。
従って、コロナウイルス感染の最初の重要なステップである受容体結合と膜融合は、どちらもSタンパク質の広範囲な天然変性領域に関連しています。 これらはSARS-CoV-2感染阻害のための主要な標的です。
膜(M)タンパク質
Mタンパク質は、ビリオンに多数見られる主要な膜貫通タンパク質です。 SARS-CoV-2は、コロナウイルスの中でも特に強力な保護外殻を持っています。これは、Mタンパク質の低い天然変性(6%)に関連している可能性があり、ウイルスの高い復元力と感染力の原因となっている可能性があります。 実際、さまざまなウイルスの感染力とそのMタンパク質の天然変性の割合には相関関係が示されおり、ディスオーダーの少ないMタンパク質はより感染力の強いウイルスとの関連しています。
今後の展望 - 製剤設計のフロンティア
現在、世界中で新しいウイルスの出現とその流行が大きな懸念事項となっています。 よってウイルスタンパク質の構造と機能に関する知識は、疾患の予防と治療に向けた新しい治療標的を特定する上で非常に重要です。
ACS Infectious Diseasesにて私どもが発表した査読付き論文では、SARS-CoV-2プロテオームのタンパク質における天然ディスオーダーの発生に関して現在利用可能な情報を要約しています。 実際、SARS-CoV-2プロテオームは相当なレベルの構造秩序を示すことが認識されています。そんな中で、Nタンパク質のみ、高度なディスオーダーが見られます。 その他のSARS-CoV-2タンパク質は、ディスオーダーの程度が低いことが特徴ですが、その既存IDPRはウイルスの機能と毒性に大きく寄与するため、抗ウイルス薬設計の有望な薬剤標的です。
IDPは広範囲に渡っており、オーダーしたタンパク質の機能を補完する多くの重要な生物学的機能を持っています。 ただし、不適切な機能(異所性発現、誤処理、誤制御など)が発生すると、IDP / IDPRは望ましくない相互作用を起こし、さまざまな病理的状態の発症に関与する傾向があります。 実際、神経変性や糖尿病、心血管疾患、アミロイド症、そして遺伝性疾患に関連する多くのタンパク質、そして大部分のヒト癌関連のタンパク質は、IDPであるか、または長いIDPRを含んでいます。
構造生物学の手法は医薬品開発に利用できますが、合理的な製剤設計の実践は、伝統的に標的タンパク質の天然変性の存在を過小評価してきました。 SARS-CoV-2およびその他の病原性プロテオームにおける天然変性タンパク質領域の構造を理解することは、COVID-19そしてそれ以降の医薬品開発にとって明確に大きなメリットがあり、製剤設計の限界を押し上げ続けることでしょう。