Gain new perspectives for faster progress directly to your inbox.
がんとの闘いが、化学療法や放射線療法という力ずくの方法のみに頼らなくなる世界は、夢物語でなくなりつつあります。もちろん、力ずくの方法はそれなりに効果はあります。しかし、しばしば患者の健康に大きな負担を強いてしまいます。 免疫腫瘍学(Immuno-oncology, IO)療法は、身体が本来有する防御機能を利用することでがん細胞と闘うもので、これにより新しい時代が切り開かれました。これは、すでに膀胱がん、乳がん、大腸がんなどの治療に有効であることが証明されています。
その他の最先端の分野と同様、IO療法の状況は広大であり、また多面的です。 それは単一のアプローチを超えた、免疫反応の強化を目的とした広範囲な方法論と戦略を網羅したものになっています。 身体の防御機能を活性化させる免疫増強剤から、特定のがん関連タンパク質を標的とするモノクローナル抗体まで、がんの免疫療法は技術革新が次々と続く、ダイナミックな分野です。
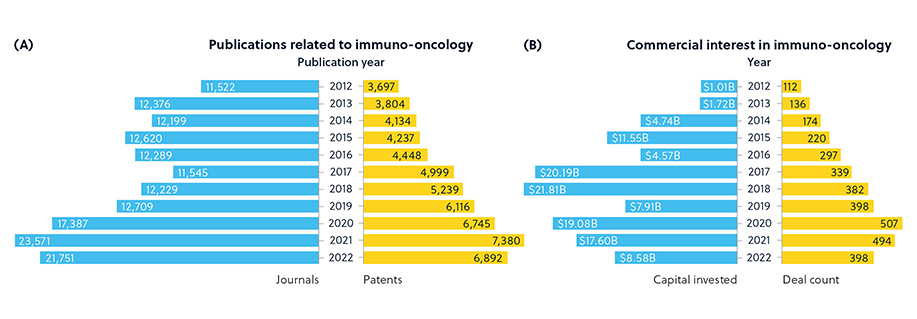
この広範囲で急速に進歩する分野の新たなトレンドとコンセプトを明らかにするために、人の手で収集した学際的な文献と物質のデータベースとしては最大規模であるCAS コンテンツコレクション™を調査しました。 近年、がんの免疫療法への関心が着実に高まってきています。 (図1).
がん免疫療法の新たなトレンドを探る
がん免疫療法に関するCAS コンテンツコレクションのデータを徹底的に分析した結果、この分野に特化した論文と特許の両方を網羅する、35万件以上の出版物からなる膨大なデータセットが得られました。 この分析作業には、主題に関する内容領域専門家(Subject Matter Expert、SME)が非常に具体的な検索クエリを作成することから始めるなど、綿密なアプローチが必要でした。 続いて自然言語処理によってフレーズが特定され、これによりSMEが手作業で厳しく精査してフレーズを微調整することが可能になりました。
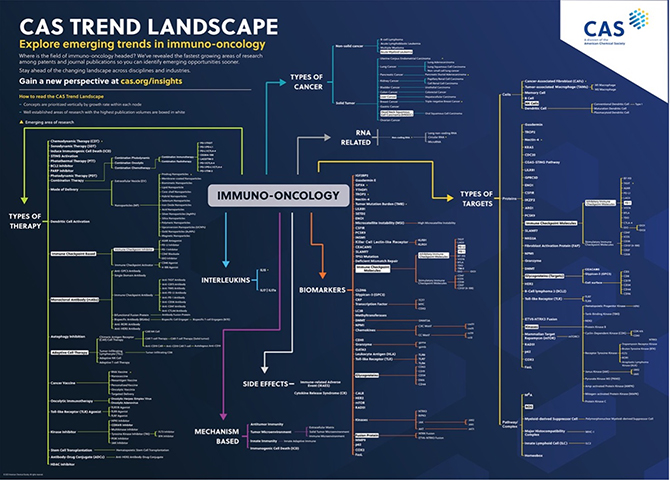
ここで、この包括的な傾向分析によって何が明らかになったのか、そしてそれは腫瘍学における免疫療法の将来にとってどのような意味を持つのか、という疑問が当然生じます。
チェックポイント阻害薬 - がん免疫療法の礎
免疫チェックポイント阻害薬は、さまざまながんの治療に新たな希望と選択肢をもたらすことで、腫瘍学の状勢に変革を引き起こしました。 そこで、出版物の大部分もこれらの分子で占めています。
PD-1(Programmed death receptor-1)阻害薬やPD-L1(programmed cell death ligand 1)阻害薬のような免疫チェックポイント阻害薬は臨床で広く使用されている一方、現在進行中の研究は、新規阻害薬の開発と、これらの画期的な治療法に対する耐性メカニズムの解明という極めて重要な2つの側面に集中しています。
しかし、各種免疫チェックポイント阻害分子への関心は一貫して高まっているわけではありません。 インドールアミン2,3-ジオキシゲナーゼ(IDO)や細胞傷害性Tリンパ球関連タンパク質4(CTLA-4)といった分子の研究は、徐々に発展していると思われる一方、アデノシンA2a受容体(A2AR)リンパ球活性化遺伝子3(LAG-3)、IgおよびITIMドメインを有するT細胞免疫受容体(TIGIT)、B7-H3などその他については将来急速に研究が発展する可能性が見られます。 このように、今回のトレンド状況の分析により、がんに対する極めて重要なこの免疫療法領域の軌跡に関して、貴重な洞察がもたらされました。そして同時に、今後のその可能性をより深く理解することにもつながっています。
抗体薬物複合体、ワクチンとその先へ - がん免疫療法のさらなる進歩を探る
がん免疫学は過去20年間に急速に進化し、時代とともに新たな標的も変化してきました(図3)。 がんにおける免疫系の役割について理解が深まったことで、チェックポイント阻害薬以外にも、キメラ抗原受容体(CAR)T細胞療法、抗体薬物複合体(ADC)、がんワクチンなど、その他の重要な免疫療法のモダリティも発展してきています。
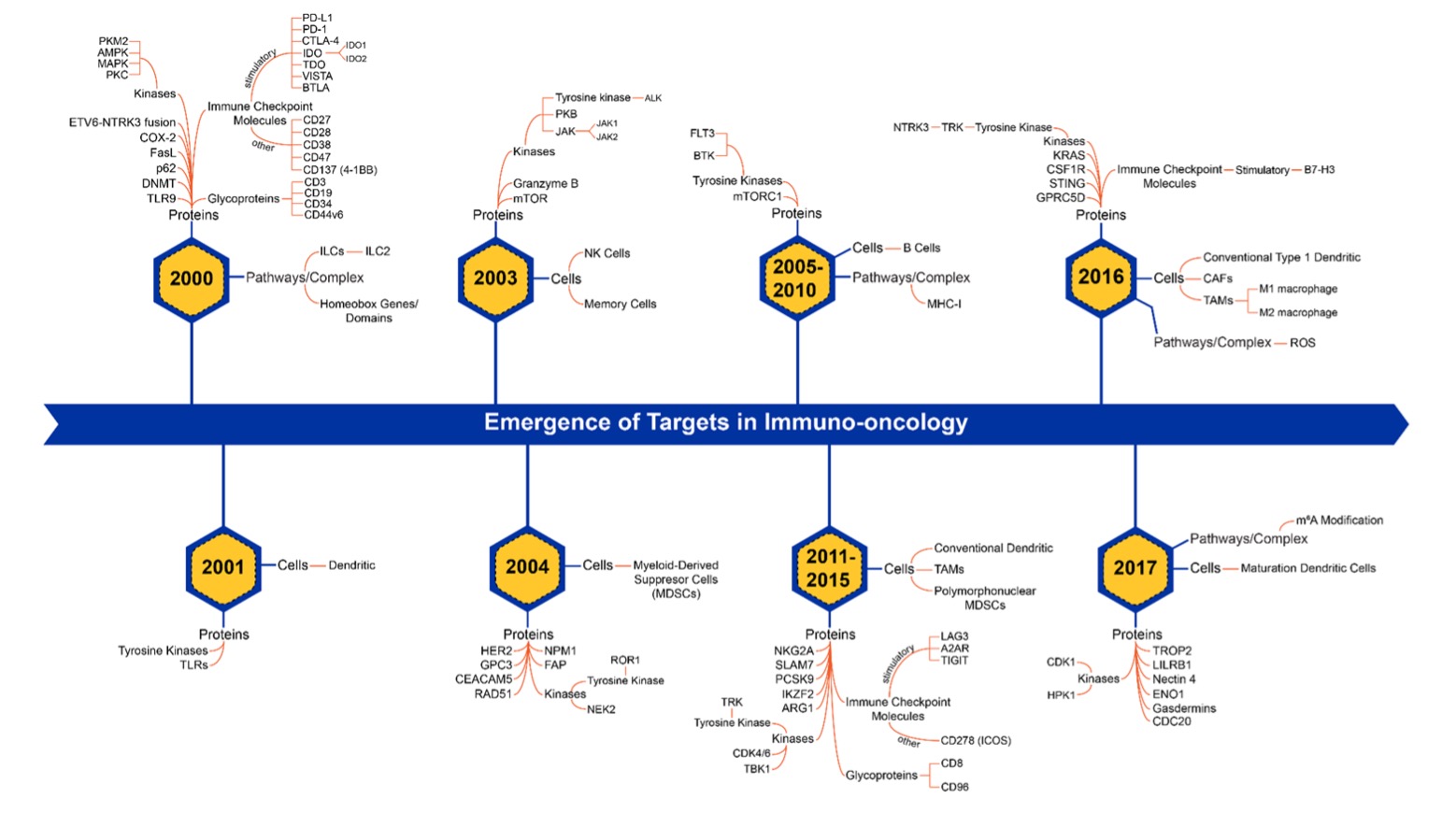
CAR-T細胞治療は、患者のT細胞を遺伝子改変し、特定の表面抗原を持つがん細胞を認識して攻撃できるようにするものです。 近年の技術革新のペースが上がっていることを反映して、CAR-T細胞に関する論文も急速に増加しており、FDAが承認したCAR-T細胞治療はすでに6種類が使用中になっています(表1)。
| 名称 | 標的抗原 | 承認年 | 企業 | 標的疾患 | CAS 登録番号 (CAS RN) |
| キムリア(Tisagenlecleucel) | CD19 | 2017年 | Novartis | B細胞急性リンパ芽球性白血病(ALL)およびB細胞非ホジキンリンパ腫(NHL) | 1823078-37-0 |
| イエスカルタ (Axicabtagene ciloleucel) | CD19 | 2017年 | Kite Pharma/Gilead | B細胞NHLおよび濾胞性リンパ腫 | 2086142-87-0 |
| Tecartus(ブレクスカブタゲンオートルユーセル) | CD19 | 2020年 | Kite Pharma/Gilead | B細胞ALLおよびマントル細胞リンパ腫(MCL) | 2691112-12-4 |
| ブレヤンジ(Lisocabtagene maraleucel) | CD19 | 2021年 | Juno Therapeutics、Bristol-Myers Squibb | B細胞NHL | 2099722-39-9 |
| Abecma (Idecabtagene vicleucel) | B細胞成熟抗原(BCMA) | 2021年 | Celgene Corporation、Bristol-Myers Squibb | 多発性骨髄腫 | 2306267-75-2 |
| Carvykti (Ciltacabtagene autoleucel) | BCMA | 2022年 | Janssen Biotech | 多発性骨髄腫 | 2641066-71-7 |
表1. FDA承認済みCAR-T細胞治療
ADCは、がんと闘うためのもうひとつの強力な武器として登場しました。 ここでは精密誘導アプローチがとられます。モノクローナル抗体と細胞毒性薬を組み合わせることで、それをがん細胞だけに送達するのです。 ADCをめぐる状況は、CAR-T細胞治療の急速な進歩と似ています。そのポートフォリオでは、すでに使用されている14のFDA承認ADCに加えて、150以上の個別候補が現在臨床試験中になっているためです。
がんワクチンは、異質のがん細胞を攻撃するよう免疫系をプログラムすることで機能します。 CASのトレンド分析では、ADCとCAR-T細胞治療の継続的な進歩を注目していると同時に、近年急速に論文数を伸ばしているがんワクチンの特定も新たなトレンドと位置づけています。 これは、がんに対する免疫療法をグローバルな規模で革命的に変化させる可能性のある、この革新的なアプローチの勢いを証明するものです。
がん免疫療法とナノ治療薬はパラダイムシフトとなるか
新しいがん免疫療法は、腫瘍部位に正確に到達させることができるかによってその有効性が決まります。 この精度は、薬物または細胞の送達システムによって達成されます。これは、標的以外への影響を最小限に抑えながら、治療効果を最大化するためには不可欠な要素です。 さらに、薬物送達システムは、複数の治療薬の同時送達を容易にすることもできます。 これにより、化学療法や放射線療法、そしてさまざまなIO療法など、その他のがん治療と併用した場合の相乗効果への道が開けます。
近年、材料科学とナノテクノロジーの進歩により、さまざまなナノ材料が誕生しています。 免疫療法での送達の主流は脂質ナノ粒子でしたが、CASのトレンド状勢分析によれば、有望な進展が見られます。 プロドラッグ送達システム、バイオミメティクス設計、そして細胞膜コーティングのナノ粒子が、注目すべきナノテクノロジーとして登場してきています(図4)。
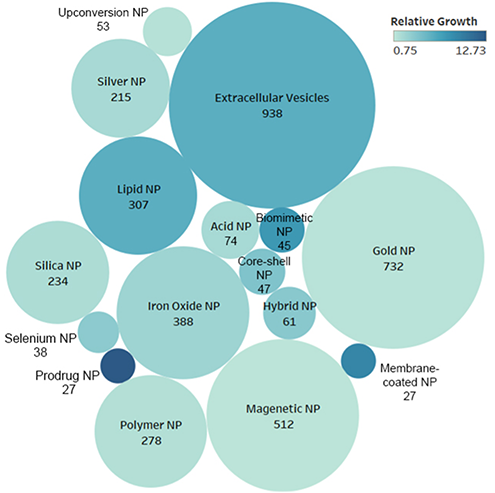
がん免疫療法の将来- 有望な可能性の到来
進化し続ける免疫腫瘍学の状況は、ますます勢いを増して発展を続けています。 新しい進歩があるたびに、画期的なIO治療のイノベーションの鍵を握る、新しい標的やバイオマーカーが次々と発見されています。 これらの画期的な発見は、未だ開発されていないがん免疫療法の可能性を証明するものです。
進化し続ける免疫腫瘍学の状況をさらに詳しく知るには、CASの査読付き文献をご覧ください。