Gain new perspectives for faster progress directly to your inbox.
神经退行性疾病严重危害着全球数百万人的生命。 这类复杂疾病涉及众多遗传和非遗传因素,但都具有病理性蛋白质聚集或蛋白质内稳态问题(蛋白质合成、折叠、分解和降解过程)。 最著名的神经退行性疾病是阿尔茨海默病和帕金森病,随着人们寿命延长和衰老的影响,这两种疾病变得越来越常见。 然而,还有一类被称为多聚谷氨酰胺 (PolyQ) 疾病的神经退行性疾病(包括亨廷顿病),给研究人员寻求治疗方案带来了更多挑战。
多聚谷氨酰胺疾病的特点是胞嘧啶-腺嘌呤-鸟嘌呤 (CAG) 三核苷酸重复的异常扩增,导致产生具有延长多聚谷氨酰胺链的蛋白质。 尽管这是一种罕见疾病,平均发病率为每 10 万人中出现 1-10 例,但多聚谷氨酰胺疾病是单基因神经退行性疾病中最大的一类疾病。 这类疾病既无法治愈,也没有预防措施,治疗起来非常复杂,而且由于其遗传性,会对整个家庭造成严重影响。
CAS 内容合集TM 是全球最大的人工标引科学信息库,通过该合集进行分析,我们进一步了解了当前的研究突破,以及应对这类致命性疾病所面临的持续挑战。
什么是多聚谷氨酰胺疾病?
目前已确定的多聚谷氨酰胺疾病有九种:亨廷顿病 (HD);第一、二、三、六、七和十七型在内的 6 种脊髓小脑共济失调 (SCA);齿状核红核苍白球路易体萎缩症 (DRPLA);以及脊髓延髓肌萎缩症 (SBMA)。 所有上述疾病均为常染色体显性遗传,只有 SBMA 为 X 连锁遗传,仅发生在男性群体中。
多聚谷氨酰胺疾病的 CAG 重复序列数与患者发病时的年龄呈反比。 疾病的严重程度呈上升趋势,而发病年龄则呈逐代下降趋势。
各种疾病所涉及的蛋白质在功能和细胞内的位置方面各不相同,且每种疾病所影响的脑区和神经元亚型也不尽相同。 然而,这些疾病的共同特征是大脑特定区域的神经元发生根本性变形,从而损害重要功能。
治疗亨廷顿病和其他多聚谷氨酰胺疾病的挑战
目前,对于亨廷顿病和其他多聚谷氨酰胺疾病尚无改变疾病进程的适用治疗方法,而且存在多个持续性挑战,给寻找治疗方法的工作带来了复杂性:
- 病理生理学的复杂性:多聚谷氨酰胺疾病涉及错综复杂的分子机制,而当前研究人员正在努力更全面地了解这些机制。
- 临床表现的多变性:这类疾病在临床表现、发病年龄和疾病进展方面表现出明显的异质性。 使得诊断和治疗工作变得更加复杂。
- 缺乏用于诊断和监测的生物标志物:可靠的生物标志物对于诊断、预后和监测治疗反应至关重要,但针对多聚谷氨酰胺疾病的有效生物标志物非常有限。
- 多重药物开发障碍:动物模型并不能完全代表这类疾病的人类疾病表型,因此在多聚谷氨酰胺研究中的价值有限。 同时,潜在的治疗方法很难穿透血脑屏障到达目标神经元,所有这些都使有效疗法的开发变得更加复杂。
研究不断增加,但仍有许多工作要做
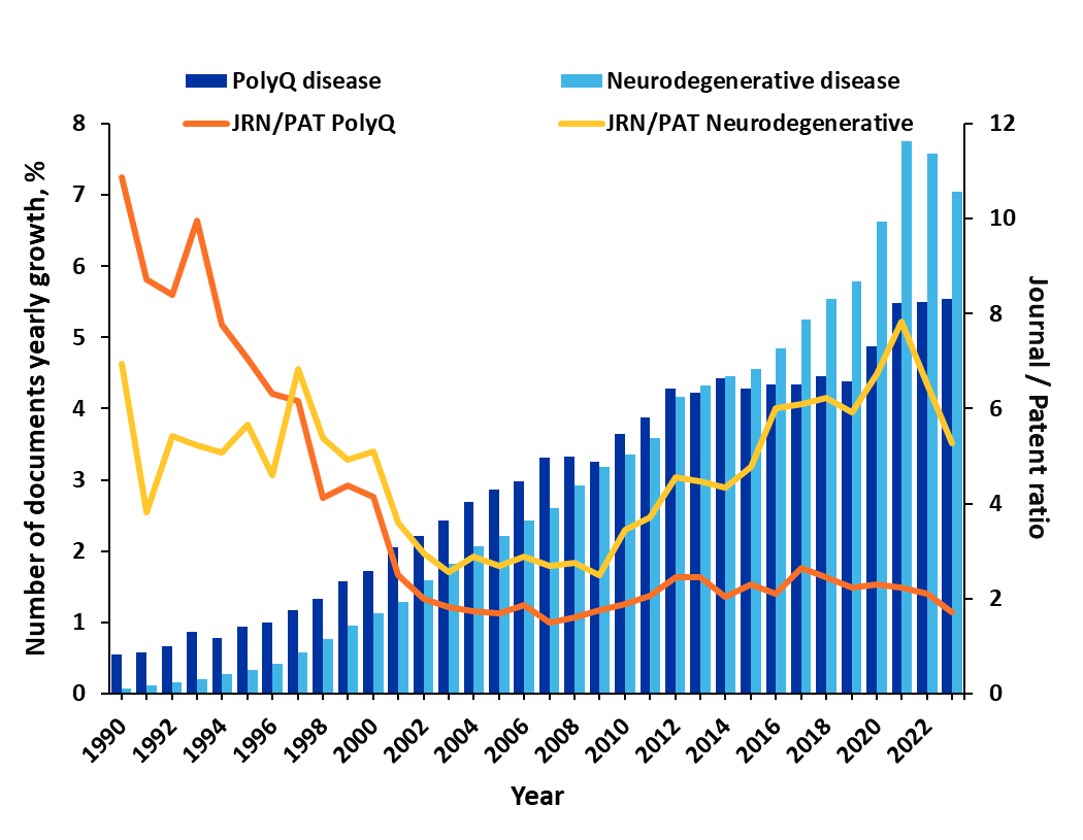
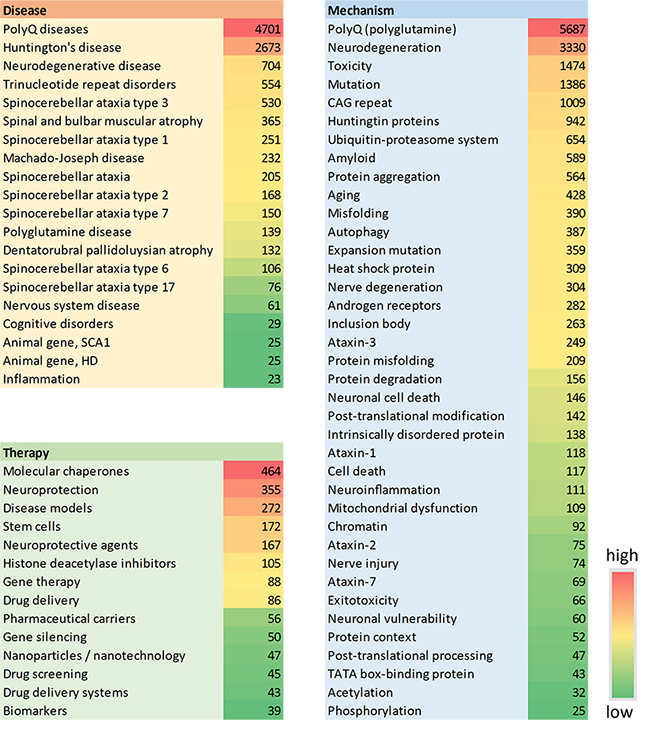
尽管面临诸多挑战,研究人员仍在努力进一步了解这些疾病和潜在的治疗方法。 我们对 CAS 内容合集的分析显示,仅在过去三年中,与多聚谷氨酰胺相关的出版物便增长了 25% 以上。 值得注意的是,在早些年,期刊出版物在研究中占主导地位,期刊与专利的比例为 4-5,但 2002 年以后,专利出版物显著增加,目前的比例接近 2(见图 1)。 这表明,治疗性发现正在向商业化迈进。
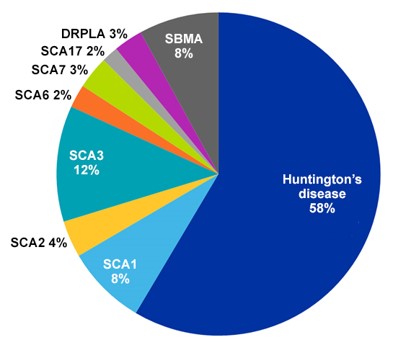
CAS 内容合集中超过一半的多聚谷氨酰胺相关文档都与亨廷顿病有关,这很容易理解,因为亨廷顿病是多聚谷氨酰胺疾病中发病率最高的一种,平均每 10 万人中就有 3 到 7 例(见图 2)。 舞蹈症是亨廷顿病最常见的症状,但该病还会导致认知变化和痴呆。 该情况是由亨廷顿基因外显子的 CAG 重复扩增所引发。
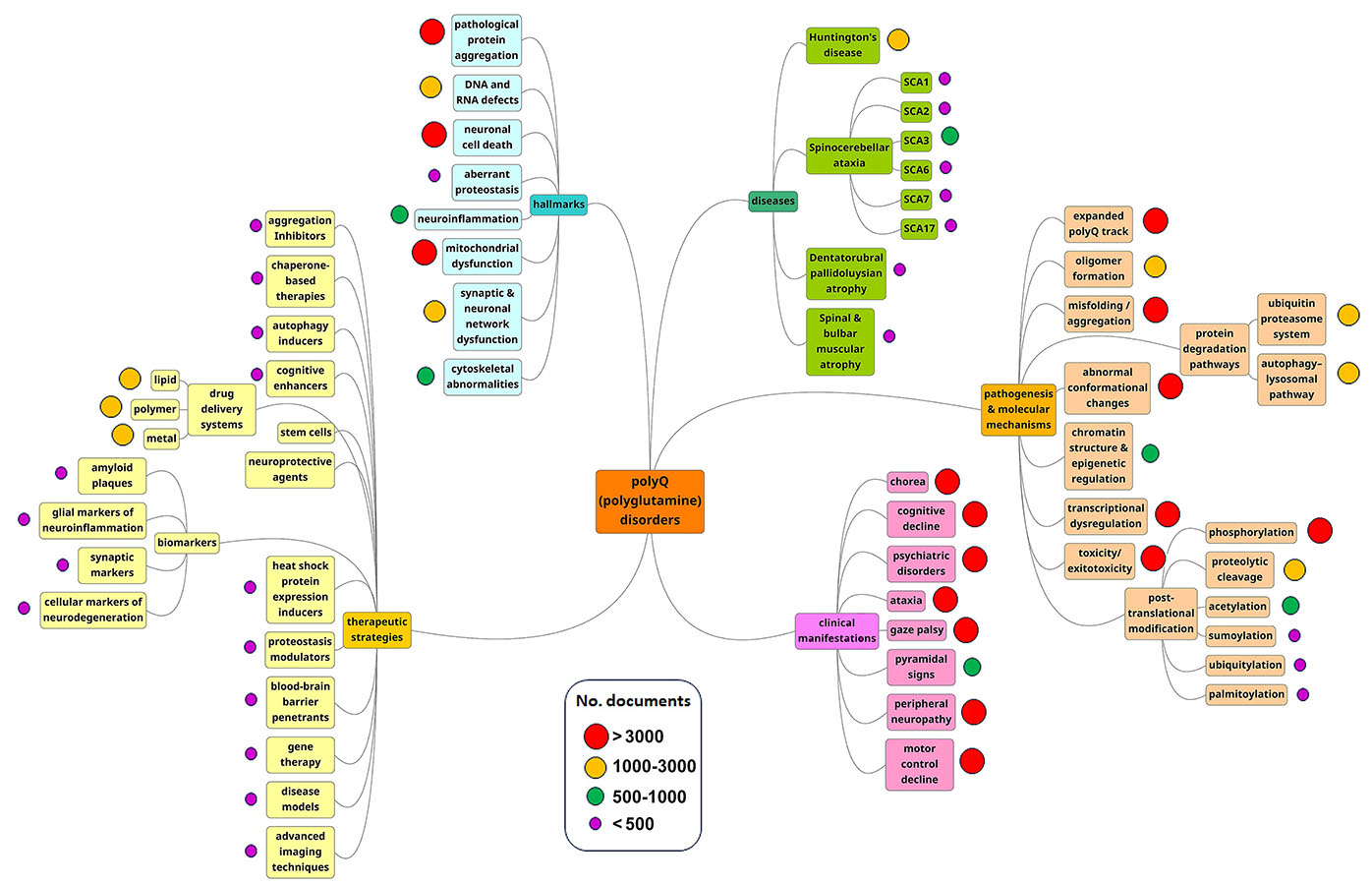
正如我们分析的思维导图所示,发病机制和分子机制是最突出的研究领域(见图 3)。 上述趋势表明,研究人员仍在努力了解这些疾病在患者和家庭中的发展过程。
治疗策略带来可能的突破
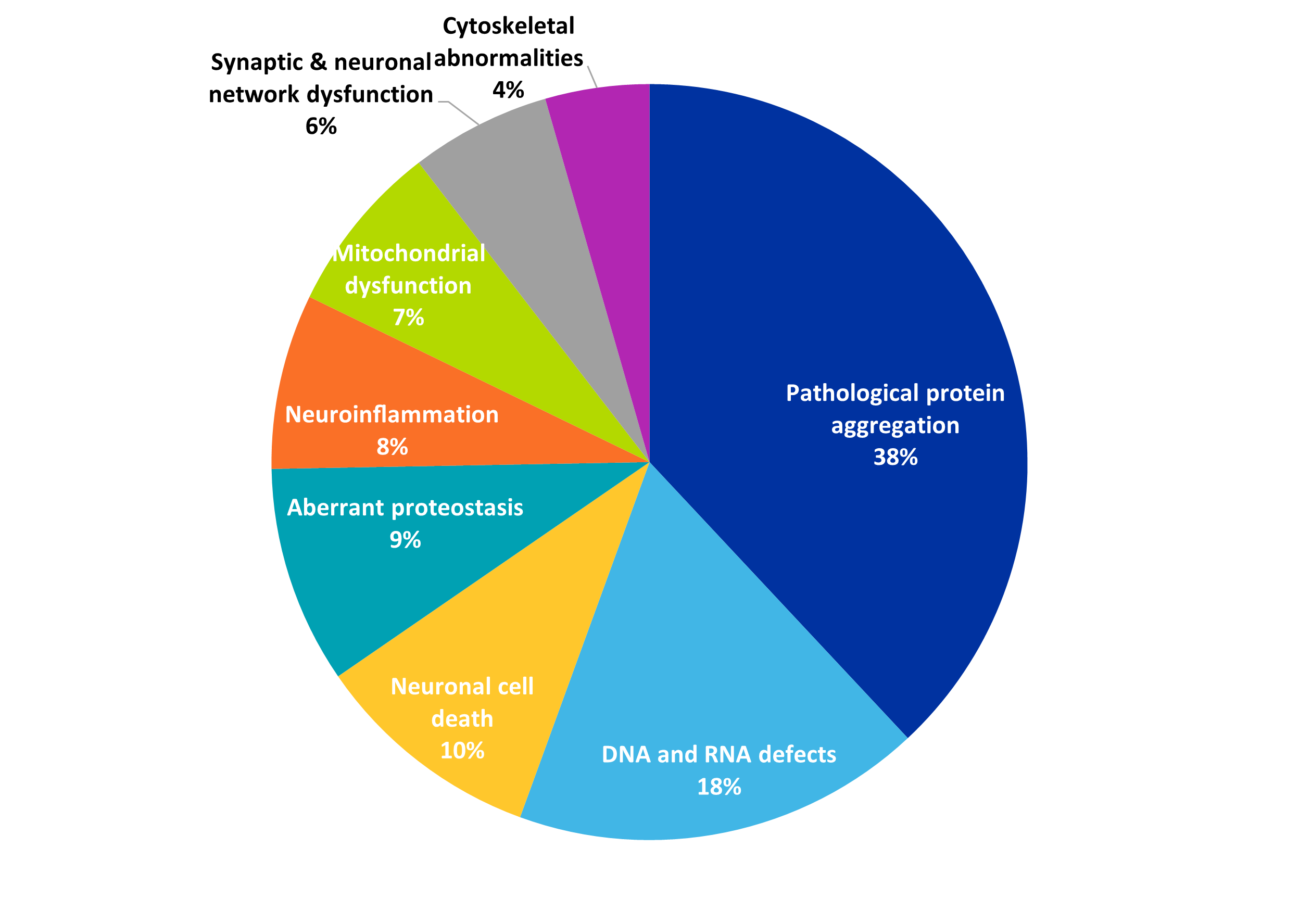
随着研究人员对蛋白质聚集和神经退行性疾病的其他特征有了进一步的了解,潜在的治疗方法和疗法也在不断增加。 正如图 4 所示,病理蛋白聚集是多聚谷氨酰胺相关出版物中最常见的疾病标志,因此它与作为治疗策略的聚集抑制剂共存是可以理解的。
在多聚谷氨酰胺相关出版物中,有多个颇具前景的研究概念非常突出:
- 分子伴侣:通过促进细胞蛋白质的正确折叠以保证其功能,或通过促进终末错误折叠蛋白质的降解以防止损伤,分子伴侣在维持细胞蛋白质稳态方面发挥着关键作用。 伴侣蛋白治疗是一种最近发展起来的治疗策略,用于治疗蛋白质错误折叠性疾病,且某些特定伴侣蛋白(如 Hsp70 家族)已被证明可以改变多聚谷氨酰胺的聚集,并抑制其毒性。 了解分子伴侣与疾病进展的相互关系对未来突破至关重要,这一概念是目前 CAS 内容合集材料中探索最多的治疗方法(见图 5)。
- 干细胞疗法:干细胞是前景广阔的再生医学工具,而治疗多聚谷氨酰胺疾病的一种新方法是利用干细胞替代受损神经元,或刺激大脑内源性神经发生通路。 在多聚谷氨酰胺模型中,人们已经成功尝试了干细胞移植。 正如图 5 所示,干细胞是多聚谷氨酰胺相关出版物中的第四大常见疗法,在疾病模型中也发挥着重要作用,排名第三。
- 细胞模型:这些模型对疾病研究至关重要,我们的分析指出,胚胎干细胞模型和诱导多能干细胞模型的开发工作包含了患者特异性遗传信息。 这些个性化基因进展有望成为治疗多聚谷氨酰胺疾病的重大突破。
- 组蛋白去乙酰化酶 (HDAC) 酶抑制剂:多聚谷氨酰胺疾病中染色质乙酰化状态严重受损,抑制 HDAC 引发的组蛋白高乙酰化具有神经保护作用。 因此,小分子 HDAC 抑制剂显示出作为治疗药物的潜力,但也存在毒性问题。 如需全面了解某些 HDAC 有益抑制剂的作用机制、所涉及的底物以及特定 HDAC 酶的作用途径,还需要进行更多研究。
- 纳米颗粒:传统的给药载体难以通过血脑屏障,而纳米载体则可以封装药物,并在这类具有挑战性的神经退行性疾病中进行靶向给药。 细胞对纳米颗粒的吸收率远高于较大颗粒,而各种材料都是颇具前景的纳米载体,包括聚合物、脂质、金属或这类材料的组合。
例如,在与亨廷顿病有关的啮齿动物试验中,人们成功施用了输送神经保护剂的固体脂质纳米粒子。 在另一项研究中,通过对患有亨廷顿病的小鼠使用 Fe2O3 聚丙烯酸酯包膜和共价共轭的聚(海藻糖)纳米载体系统,其大脑神经细胞中的多聚谷氨酰胺聚集也受到了阻碍。
- 生物标志物:将生物标志物与临床评估相结合,可以促进潜在疗法的诊断和评估。 研究人员正在探索多聚谷氨酰胺疾病的生物标志物,这些标志物无需通过尸检或过度侵入性的措施采集,而这一概念的突破有望极大改善诊断,提供更好的预后信息,并促进对疾病进展和治疗方法的分析。 这类潜在生物标记物包括基于血液的分子(如突变蛋白片段或微小核糖核酸)、神经影像(如 MRI 扫描)、与氧化应激和炎症有关的标记物,以及通过基因组测序获得的遗传修饰因子。
- 基因疗法:有朝一日,基因疗法可能会包括基因沉默或抑制导致多聚谷氨酰胺紊乱的突变基因。 这类疗法在治疗 SBMA、SCA1 和亨廷顿病的动物试验中取得了可喜成果,但基因编辑技术还存在许多伦理和配送方面的问题,必须在广泛采用之前加以解决。
少量但不断增长的临床试验
多聚谷氨酰胺疾病的临床试验相对较少,反映了该疾病的相对罕见性。 我们的分析显示,在过去 10 年中,登记在册的临床试验约有 200 项。 相比之下,美国国家老龄化研究所 (National Institute on Aging) 目前针对阿尔茨海默病的临床试验数量是该数字的两倍多。 然而,许多临床试验正处于招募阶段,这意味着这些难以治疗的疾病可能即将取得突破性进展(见图 6)。
多聚谷氨酰胺研究的未来
亨廷顿病和其他多聚谷氨酰胺疾病均为复杂疾病,在制定成功的治疗策略方面面临诸多挑战。 不过,随着我们对神经退行性病变过程认识的加深,治疗这类疾病的临床研究也有望取得重大进展。
我们对 CAS 内容合集的分析表明,未来的研究方向有几个潜在的重点领域。 开发预防或分离毒性蛋白质聚集的新策略至关重要。 了解基因修饰因子和确定基因治疗方法可以开启许多治疗或治愈途径,而确定生物标志物以开展更明确的诊断和治疗评估,这将为临床医生提供更多的疾病管理选择。
鉴于多聚谷氨酰胺疾病的复杂性,研究人员必须探索将不同治疗方法相结合可能产生的协同效应。 成功可能意味着减缓或阻止影响当今社会的一些最具挑战性和衰竭性的神经退行性疾病。