L'enzyme de conversion de l'angiotensine 2 (ACE2) est une protéine qui a suscité une grande attention ces dernières années pour son rôle en tant que récepteur du virus SARS-CoV-2, mais la multitude de recherches sur l'ACE2 a également révélé ses possibilités intéressantes en tant que cible thérapeutique dans un certain nombre d'autres maladies.
Qu'est-ce que l'ACE2 ?
L'ACE2 est une protéine membranaire dont le domaine enzymatique est situé à la surface extérieure des cellules humaines. Elle doit son nom au fait que cette protéine a été identifiée pour la première fois en tant qu'homologue (ou variant) de l'enzyme de conversion de l'angiotensine (ACE), une enzyme qui induit la formation de l'hormone peptidique angiotensine II à partir de l'angiotensine I. L'ACE a fait l'objet d'études intensives et est un vasoconstricteur bien connu (c'est-à-dire qu'il provoque une contraction des muscles des parois des vaisseaux sanguins et un rétrécissement de la lumière des vaisseaux sanguins).
L'ACE2, aujourd'hui connu comme récepteur viral, se comporte aussi comme un vasodilatateur qui contrebalance l'ACE et provoque une relaxation des parois des vaisseaux sanguins. L'ACE et l'ACE2 sont des intervenants importants du système rénine-angiotensine (RAS) qui régule la tension artérielle et le flux sanguin vers de multiples organes, dont les poumons, le cœur et les reins.
Fonctions de l'enzyme de conversion de l'angiotensine 2
Le système rénine-angiotensine comprend un réseau complexe d'enzymes, d'hormones peptidiques et de récepteurs, comme l'illustre la Figure 1. L'angiotensinogène, le précurseur de l'angiotensine (Ang) secrété par le foie, est divisé par la rénine, une enzyme rénale, pour produire l'angiotensine I (Ang I). L'Ang I est ensuite convertie en Ang II par l'ACE. L'Ang II, un peptide hormonal contenant huit acides aminés, se lie aux récepteurs de l'angiotensine de type 1 (AT1R) à la surface des cellules musculaires dans les petits vaisseaux sanguins pour provoquer la vasoconstriction. Il promeut aussi la réabsorption du sodium par les reins. La vasoconstriction et la réabsorption sodique entraînent une élévation de la tension artérielle. Ainsi, une activité anormalement élevée d'ACE produit des niveaux supérieurs d'Ang II, provoquant une hypertension.
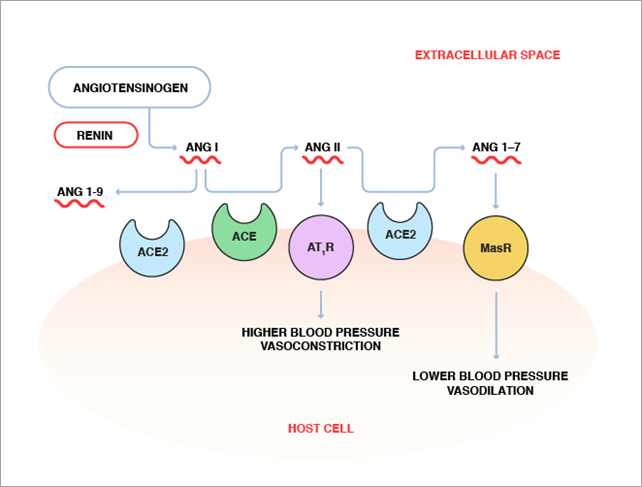
À l'inverse, l'ACE2 catalyse la conversion du peptide à huit acides aminés, l'Ang II, en un peptide à sept acides aminés (Ang 1-7), qui semble avoir l'effet opposé à celui de l'Ang II en agissant sur un récepteur différent, appelé récepteur Mas (MasR). Alors que le rôle précis de l'Ang 1-7 sur la régulation de la tension artérielle n'a pas été entièrement élucidé, des preuves indiquent qu'il réduit la tension artérielle et induit la vasodilatation. En outre, l'ACE2 divise l'Ang I en Ang 1-9 et, en conséquence, pourrait contrebalancer les effets de l'ACE en éliminant son substrat. En provoquant la conversion de l'Ang II en Ang (1-7) et celle de l'Ang I en Ang 1-9, l'ACE2 pourrait jouer un rôle dans le maintien de l'équilibre entre vasoconstriction et vasodilatation pour contrôler la tension artérielle.
Le rôle de l'ACE2 dans l'infection au SARS-CoV-2
Depuis la pandémie de COVID-19, les scientifiques s'efforcent de comprendre très rapidement le virus SARS-CoV-2, d'élucider le mécanisme de progression de la maladie et d'identifier des options de traitement. Des recherches intensives ont été consacrées à l'identification de gènes et de protéines viables en tant que cibles pour les agents thérapeutiques et, au début de la pandémie, on a identifié un rôle important de l'ACE2 en tant que récepteur du virus SARS-CoV-2.
L'ACE2 peut être identifié par la protéine spike (protéine S) à la surface du virus SARS-CoV-2 ou SARS-CoV. L'ACE2 et la protéine S se lient de manière analogue à celle d'une interaction de type « clé dans la serrure », ce qui permet au virus de pénétrer dans les cellules humaines (Figure 2).
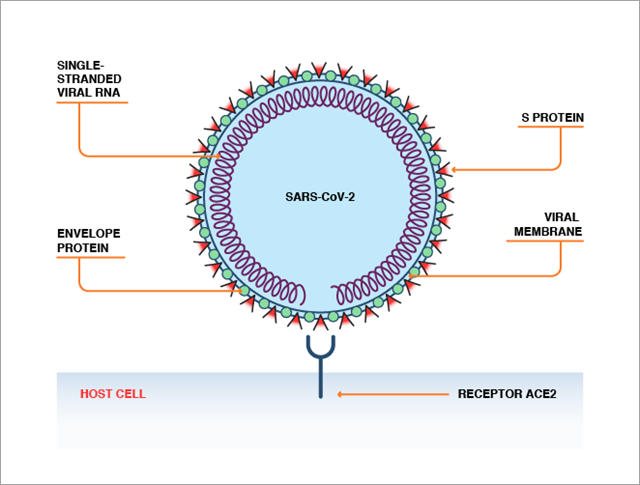
Bien que le SARS-CoV-2 soit très similaire au SARS-CoV, le virus qui a provoqué le SARS (syndrome respiratoire aigu sévère), quelques mutations du domaine de liaison du récepteur de la protéine S ont nettement augmenté l'affinité de liaison du virus SARS-CoV-2 avec l'ACE2. Ces différences pourraient expliquer le caractère plus contagieux de la COVID-19. Des preuves indiquent que l'ACE2 est exprimé dans nos poumons, notre système digestif, notre cœur, nos artères et nos reins. L'expression de l'ACE2 augmente également avec l'âge et est plus élevée chez les patients atteints de maladies cardiovasculaires, ce qui pourrait expliquer la gravité accrue de la COVID-19 dans ces sous-groupes.
Interactions de la protéine ACE2 dans les traitements de la COVID-19
Même si elle fait office de site d'amarrage du SARS-CoV-2 et favorise la pénétration du virus dans les cellules hôtes, l'ACE2 pourrait ne pas agir seule. D'autres enzymes hôtes sont également impliquées dans l'entrée du virus. Des enzymes appelées protéases sont responsables de l'élimination de fragments d'ACE2 et de protéine S pour améliorer leur processus d'interaction. D'autres enzymes modifient le complexe ACE2-protéine S intégré à des vésicules liées à la membrane pour faciliter la pénétration virale dans la cellule hôte. En conséquence, l'ACE2 et son interaction avec le SARS-CoV-2, ainsi que les autres protéines impliquées dans ce processus, pourraient constituer des cibles valides pour les agents anti-COVID-19.
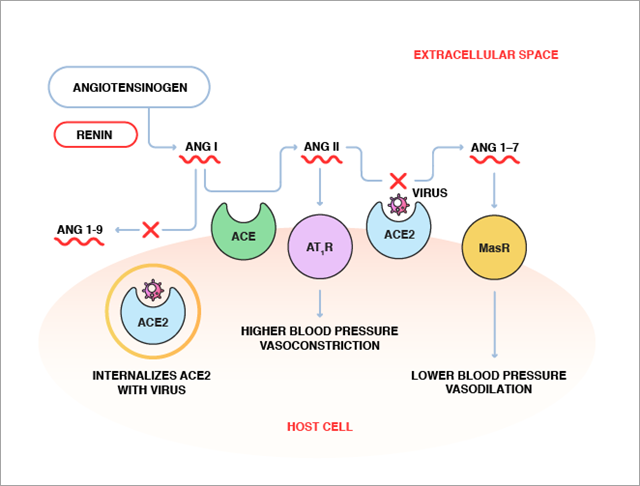
Lors de la liaison virale, on pense que le domaine catalytique de l'ACE2 pourrait être bloqué par le virus, ce qui limiterait l'accès au substrat, l'Ang II, provoquant ainsi une accumulation d'Ang II. En outre, avec la pénétration virale, l'ACE2 de surface pourrait être intériorisée dans les cellules, diminuant ainsi la fonction enzymatique de l'ACE2 (Figure 3). En conséquence de l'activité réduite de l'ACE2, les niveaux d'Ang II en circulation pourraient augmenter, comme on l'a signalé chez les patients atteints de la COVID-19. Le niveau d'Ang II démontre une corrélation positive linéaire avec la charge virale et la lésion des poumons, ce qui indique un lien direct entre la régulation à la baisse de l'ACE2 dans les tissus, le déséquilibre de RAS et le développement de lésions organiques chez les patients atteints de la COVID-19. D'autres études seront toutefois nécessaires pour confirmer ce résultat.
Le potentiel de l'ACE2 en tant que cible pour les traitements contre la COVID-19
En raison du rôle crucial de l'ACE2 dans l'invasion des cellules hôtes par le SARS-CoV-2, des efforts sont en cours pour développer des médicaments qui pourront bloquer cette fonction. À ce jour, aucun médicament à petite molécule n'a été approuvé pour une réutilisation dans ce but. Toutefois, un médicament biologique récemment développé pourrait atteindre cet objectif. Ce médicament de grade clinique, l'ACE2 soluble recombinant humain (hrsACE2), a été développé initialement pour combattre le syndrome de détresse respiratoire aiguë (SDRA).
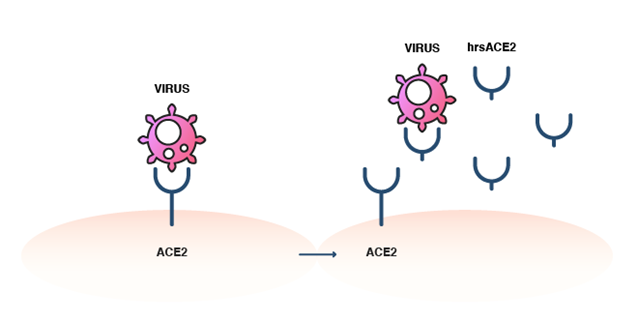
Le hrsACE2 ne possède pas le segment transmembranaire et, par conséquent, ne s'attache pas aux cellules humaines. Il est cependant capable de lier le virus SARS-CoV-2 en tant que récepteur leurre. En se liant de manière compétitive à ce coronavirus, il empêche la liaison virale à l'ACE2 membranaire naturel et, ainsi, bloque l'entrée du virus dans les cellules hôtes (Figure 4). Des études sur des cultures de cellules et différents organoïdes ont bien démontré que le hrsACE2 empêche le virus d'infecter les cellules hôtes. Il semblait également bien toléré et a provoqué une diminution rapide des niveaux d'Ang II chez les patients atteints de SDRA lors d'un essai clinique réalisé en 2017. On peut espérer que le hrsACE2 deviendra le premier médicament à cibler l'ACE2 et qu'il ouvrira la porte à des traitements ciblés dans la lutte contre la COVID-19. Il est encourageant de noter que le hrsACE2 présente un potentiel en tant que traitement combiné, en améliorant l'efficacité du remdesivir contre l'infection par le SARS-CoV-2.
Applications thérapeutiques futures de l'ACE2
Au-delà de la COVID-19, le parcours de l'ACE2 offre une voie potentielle de traitement d'autres maladies respiratoires, comme la nouvelle grippe 2009 (H1N1) et la grippe aviaire (H5N1), éventuellement en développant l'ACE2 recombinant à utiliser conjointement avec un inhibiteur de l'AT1R ou un inhibiteur de l'ACE. Les maladies cardiovasculaires sont un autre domaine dans lequel l'ACE2 suscite un intérêt croissant et de nouvelles cibles comme l'ACE2 pourraient aider à trouver des moyens plus efficaces de cibler l'hyperactivité du RAS qui joue un rôle majeur dans des troubles tels que l'hypertension. L'ACE2 pourrait aussi probablement être une cible importante dans la lutte contre le diabète de type 2, par exemple, en utilisant des parcours véhiculés par l'ACE2 pour combattre les effets de l'Ang II suractive dans le rein diabétique.
Le rôle émergent de l'ARN dans le développement de nouveaux traitements transforme le monde de la découverte de médicaments : gardez donc une longueur d'avance avec CAS. Lisez notre rapport Insight sur le monde émergent des traitements à l'ARN.