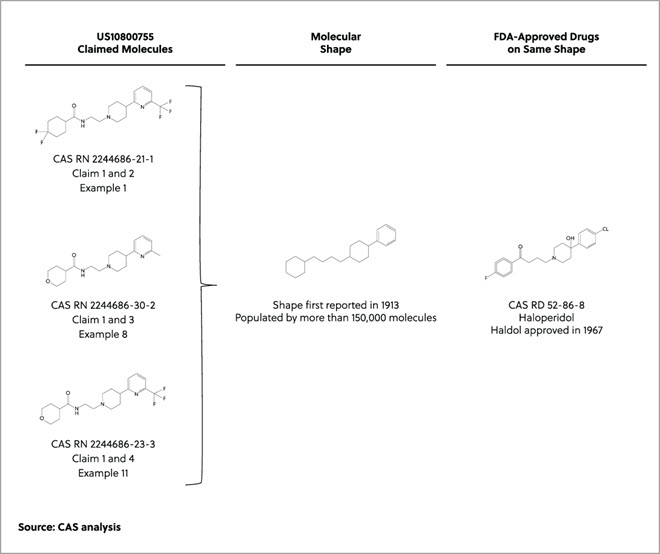
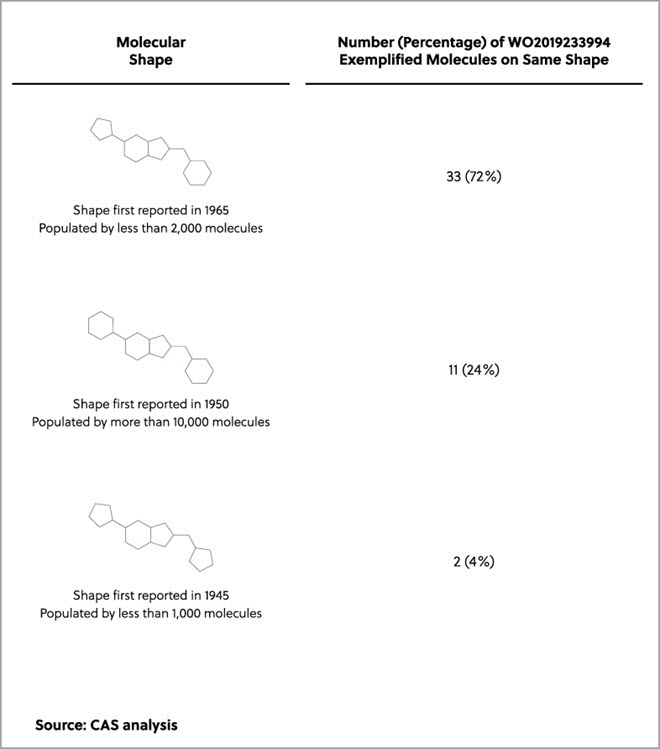
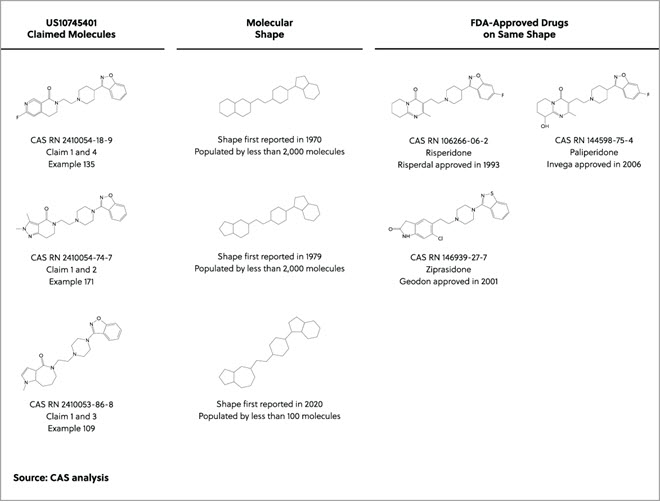
Avec l'élévation du niveau des mers et le changement climatique qui affectent les communautés du monde entier, les pays industrialisés cherchent à gérer leur production et à identifier les processus visant à réduire leur impact sur l'environnement. Une approche, qui a pris de l'ampleur depuis les années 1990, est la chimie verte, un domaine scientifique axé sur « l'invention, la conception et l'application de produits et procédés chimiques afin de réduire ou d'éliminer l'utilisation et la génération de substances dangereuses ».
En 1998, Paul Anastas et John Warner ont co-écrit un livre exposant les 12 principes de base de la chimie verte, dont une série de moyens de réduire l'impact environnemental et humain de la production chimique. Toutefois, dans certaines industries, l'adoption de pratiques de chimie verte est considérée comme un compromis injustifié en termes de rentabilité.
Faire des vagues dans l'industrie pharmaceutique avec la chimie verte
Selon l'ACS Green Chemistry Institute, « après tous les progrès de la recherche dans la chimie et l'ingénierie vertes, les entreprises chimiques généralistes n'ont pas encore pleinement adopté cette technologie. Aujourd'hui, plus de 98 % des produits chimiques organiques sont encore dérivés du pétrole. »Alors que le mouvement de la chimie verte continue à influencer la politique, les pratiques professionnelles et la perception des consommateurs, les entreprises doivent trouver de nouveaux moyens de « se verdir » tout en préservant leurs résultats financiers. C'est le cas en particulier dans l'industrie pharmaceutique.
L'ACS Green Chemistry Institute a constitué la Table ronde pharmaceutique ACS GCI pour « encourager l'innovation tout en catalysant l'intégration de la chimie verte et de l'ingénierie verte dans l'industrie pharmaceutique ».Les membres de cette table ronde comprennent AstraZeneca, Bayer, Lilly, GlaxoSmithKline, Merck & Co., Novartis, Pfizer et Takeda, entre autres
La participation de tant de laboratoires pharmaceutiques très célèbres est encourageante, car ce secteur s'est montré historiquement réticent à modifier des méthodes de fabrication et de recherche qui avaient fait leurs preuves. Bien que l'adoption des principes de la chimie verte puisse être considérée comme un obstacle supplémentaire pour une industrie déjà confrontée aux problèmes de réglementation, aux exigences liées à la propriété intellectuelle et aux échecs rapides, les laboratoires pharmaceutiques commencent à comprendre l'efficacité et les économies que cela représente.
En appliquant le principe de l'économie atomique de la chimie verte (c'est-à-dire la conception de méthodes de synthèse dans le but d'optimiser l'incorporation de tous les matériaux utilisés dans le procédé au produit final) dans la R&D pharmaceutique, le nombre de sous-produits est réduit, ce qui optimise les coûts de stockage et d'élimination.Les solvants peuvent aussi impacter considérablement les coûts, car ils représentent 50 à 80 % de la masse d'une opération chimique par lot standard et l'essentiel de la consommation d'énergie, et sont à l'origine des plus grandes préoccupations en termes de sécurité des procédés.
Par exemple, Merck a développé un moyen plus vert d'utiliser le molnupiravir, un médicament antiviral destiné au traitement de la COVID-19. Les avantages comprennent la réduction des déchets de solvant, l'augmentation du rendement de 1,6 fois et la réduction d'un procédé en cinq étapes à une opération en trois étapes. En 2022, l'agence américaine de protection de l'environnement a salué ces travaux en leur décernant le prix Greener Reaction Conditions Award.
Amgen a développé une synthèse plus écologique avec LUMAKRAS™, un nouveau médicament destiné au traitement de certains cancers du poumon non à petites cellules. Les avantages comprennent la suppression d'une étape de purification qui générait de grandes quantités de déchets de solvant, ce qui permet une économie de 3,17 millions de livres par an et dynamise le rendement. En 2022, l'agence américaine de protection de l'environnement a également salué ces travaux en leur décernant le prix Greener Reaction Conditions Award.
Garder une avance sur la courbe de la chimie verte
Au cœur de tout laboratoire pharmaceutique se situe une promesse de production de médicaments innovants qui amélioreront des vies dans le monde entier. Pour atteindre cet objectif de manière durable et écologique, les laboratoires pharmaceutiques ont besoin d'accéder aux toutes dernières recherches dans ce domaine. Ils doivent innover au-delà des procédés de synthèse traditionnels.
À partir de la fin des années 1990 et coïncidant avec la publication de l'ouvrage révolutionnaire d'Anastas et Warner, on a constaté une intensification spectaculaire de la recherche liée à l'utilisation de la chimie verte dans la conception et la synthèse d'agents pharmaceutiques. Aujourd'hui, la littérature scientifique comprend plus de 2,1 millions d'articles de revues concernant ce sujet.
Comme dans de nombreux domaines émergents, l'utilisation d'une terminologie incohérente dans la littérature scientifique présente un défi pour ceux qui cherchent à exploiter les dernières découvertes. Les laboratoires pharmaceutiques ont besoin de solutions d'information qui permettent à leurs chercheurs de localiser facilement des réactions, réactifs, solvants et catalyseurs plus écologiques tandis qu'ils optimisent leurs synthèses dans un souci de durabilité.
Chez CAS, nos scientifiques indexent les informations liées à la chimie verte tout en organisant la plus grande collection mondiale d'informations chimiques. Cette indexation intellectuelle permet aux chercheurs de l'industrie pharmaceutique d'accéder rapidement aux informations de chimie verte dont ils ont besoin, dont plus de 45 000 réactions chimiques « vertes » dans l'incomparable CAS collection de contenus™.
CAS fournit également des points de vue sur le paysage des dernières tendances en matière de chimie verte qui pourraient influer sur d'autres aspects de la fabrication, notamment le développement des emballages. Pour en savoir plus, lisez le rapport CAS Insight qui explore les « Polymères biologiques : une alternative verte aux plastiques traditionnels ».





 Téléchargez l'étude de cas
Téléchargez l'étude de cas