Une étape critique de la course au développement de traitements contre la COVID-19 consiste pour les scientifiques à comprendre clairement la manière dont le virus pénètre dans nos cellules. Ces informations soutiendront le développement de traitements antiviraux ciblés axés sur le blocage de cette voie de contamination.
Les recherches menées sur le premier virus SARS-CoV, qui est apparu en 2002 et a provoqué une épidémie, ainsi que sur le SARS-CoV-2, le coronavirus parent qui cause aujourd'hui la COVID-19, montrent que dans les deux cas, une protéine spike (S) dépassant de la membrane virale se lie à au moins une protéine, l'enzyme de conversion de l'angiotensine 2 (ACE2) à la surface des cellules humaines. Après cette liaison, les protéases, qui sont des enzymes humaines qui divisent d'autres protéines, coupent, ou « préparent » la protéine spike à éliminer son segment extérieur, nommé S1, et à révéler son segment intérieur, nommé S2. Le segment S2 de la protéine spike provoque ensuite une fusion de la membrane virale avec les membranes cellulaires humaines, permettant au matériau génétique viral de pénétrer la cellule et de commencer à se répliquer. Une publication récente résumait ce processus en mettant en évidence le rôle de l'ACE2. Dans cette publication, j'examinerai plus en détails le rôle des protéases humaines pour aider le virus à pénétrer nos cellules et mettre en évidence des traitements antiviraux ciblant cette interaction.
La protéine spike du SARS-CoV-2 : une histoire en deux segments
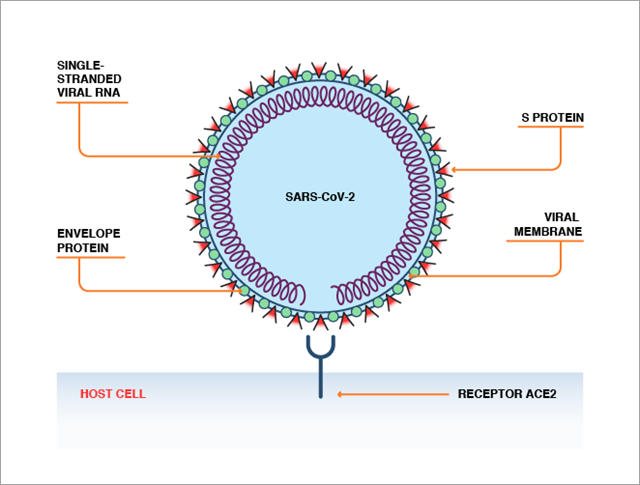
La protéine spike du SARS-CoV-2 présente une forme de vis avec une tête plus grande et une tige fine et longue (Figure 1). Ces protéines spike se lient les unes aux autres pour former un trimère, dont la forme ressemble logiquement à celle d'une vis plus grande. La tige est insérée dans la membrane virale et maintient la tête vers l'extérieur et à l'écart du virus. La zone plus grosse de la tête et une partie de la tige sont appelées région S1 de la protéine spike. La partie restante de la tige, plus proche de la membrane virale, est appelée région S2.
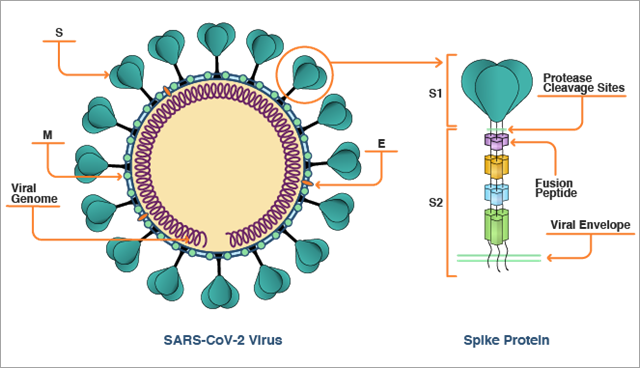
Une fois qu'elle pénètre l'organisme et entre en contact avec le système respiratoire, le conduit gastro-intestinal, un vaisseau sanguin ou d'autres cellules qui expriment l'ACE2 à leur surface, la région S1 de la protéine spike se lie à l'ACE2 à la surface de la cellule et ancre le virus à l'extérieur de la cellule humaine. C'est la première étape du processus de réplication virale.
Le SARS-CoV-2 pénètre les cellules d'une manière ou d'une autre
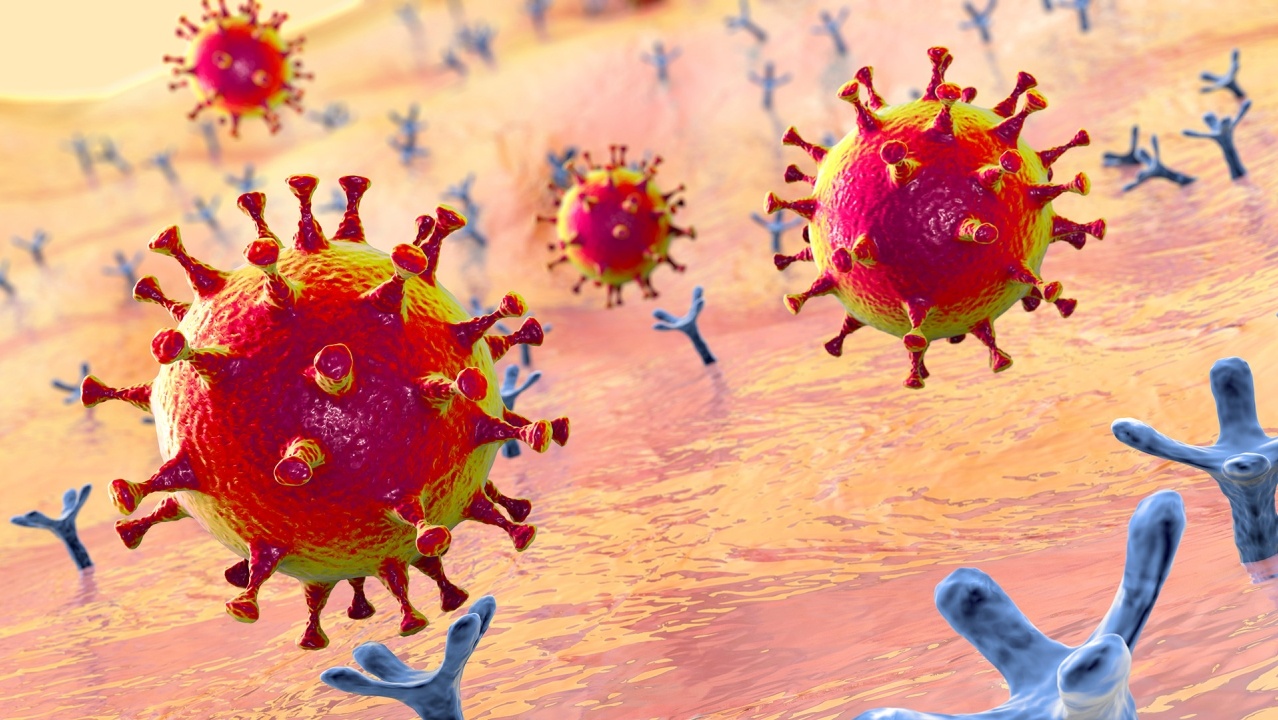
Une fois lié à la cellule, le virus dispose de deux voies potentielles pour la pénétrer (Figure 2). La voie choisie dépend de la présence ou non de protéases humaines pour « amorcer » la protéine spike. La présence de protéases dépend du type de cellule humaine que le virus attaque et de l'état particulier de cette cellule. Plusieurs protéases humaines sont en mesure de diviser la protéine spike, notamment la protéase transmembranaire à sérine 2 (TMPRSS2), la furine, l'élastase et la trypsine. La TMPRSS2 est exprimée par les cellules pulmonaires humaines. On pense donc qu'elle joue un rôle important dans la pénétration du virus dans les cellules des voies respiratoires.
Si ces protéases sont présentes à proximité de l'interface de liaison entre la protéine spike et l'ACE2, elles divisent la protéine spike pour exposer la région S2 et en particulier la région du peptide de fusion de la protéine spike. Cette région du peptide de fusion de la protéine spike est constituée d'acides aminés plus hydrophobes ou similaires à des lipides, et elle s'insère dans la membrane cellulaire contenant des lipides afin d'induire la fusion entre membrane virale et cellule membranaire, et de permettre ainsi l'entrée du génome viral dans la cellule (Figure 2a). Cette scission doit se produire après la liaison entre la protéine spike et l'ACE2. Si elle intervient plus tôt, le virus est moins à même d'infecter la cellule.
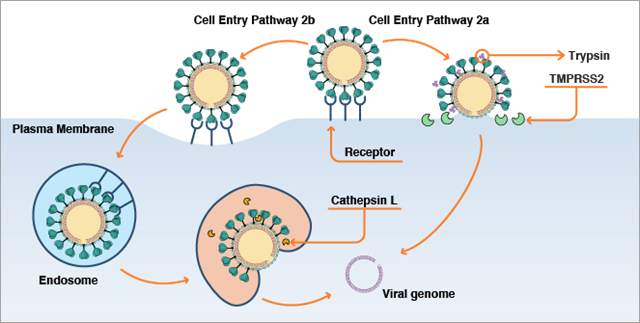
Si des protéases ne sont pas présentes à proximité de l'interface de liaison entre la protéine spike et l'ACE2, le virus entrera dans la cellule par une voie différente appelée endocytose (Figure 2b). Dans ce processus, les coronavirus liés à des protéines ACE2 en dehors de la cellule sont happées par une brèche dans une petite région de la membrane cellulaire, qui se pince ensuite pour former une vésicule endocytique et faire entrer le matériau extérieur dans la cellule. Après cela, la vésicule endocytique fusionne avec une vésicule à paroi membranaire intracellulaire appelée endosome. Dans l'endosome, des protéases sont présentes, notamment la cathepsine L, qui peut diviser la protéine spike et exposer sa région du peptide de fusion. Le peptide de fusion induit ensuite la fusion de la membrane virale avec la membrane de l'endosome et, ainsi, provoque l'entrée ultérieure du génome viral dans la cellule.
Des preuves récentes suggèrent qu'il pourrait exister une troisième voie d'entrée du SARS-CoV-2 dans les cellules. Lorsque le virus se réplique et crée de nouvelles particules virales dans les cellules, certaines protéines spike peuvent être pré-divisées ou pré-amorcées par une protéase humaine appelée furine au cours du processus d'assemblage du nouveau virus. Cela signifie qu'une fois que le virus sort de la cellule, ces virus dotés de protéines spike pré-amorcées peuvent fusionner avec d'autres cellules et les infecter, même si ces autres cellules possèdent des niveaux faibles de protéases présentes pour l'une des deux voies « normales » de division de la protéine spike décrites ci-dessus.
Planification d'une contre-attaque
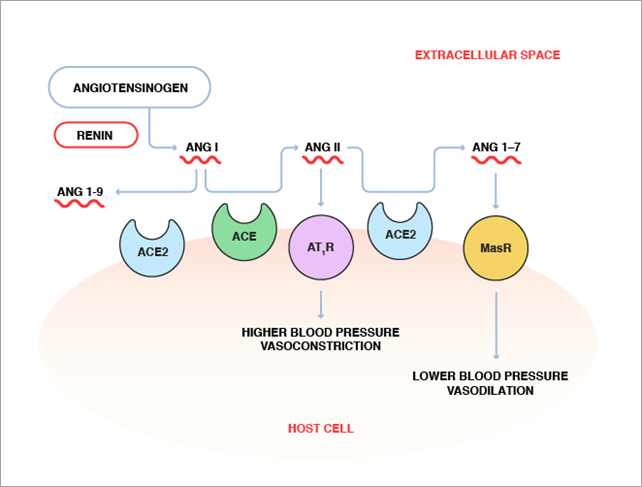
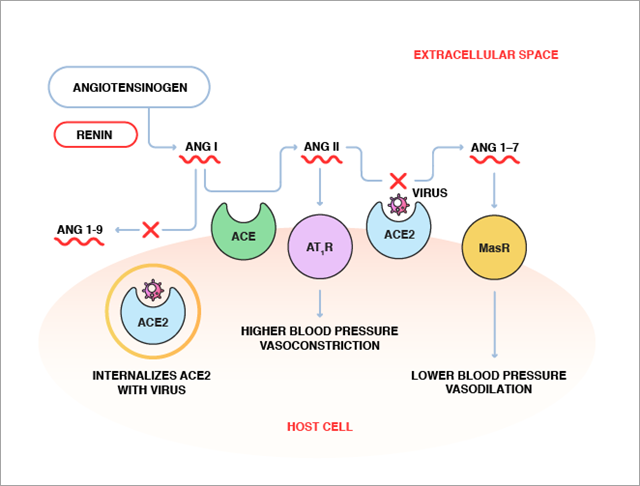
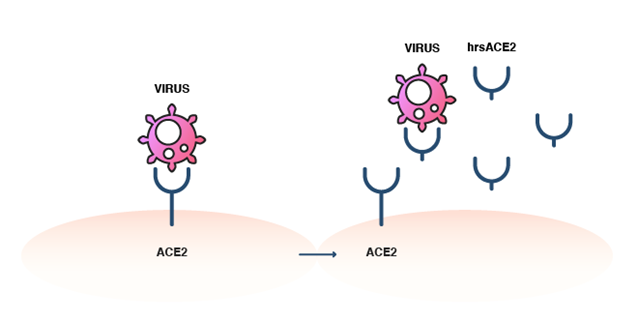
Les chercheurs s'efforcent de trouver des médicaments capables de cibler la partie protéine spike-ACE2-fusion membranaire-endocytose du cycle de vie de l'infection afin d'éradiquer la COVID-19. Notre publication précédente présenterait l'ACE2 soluble recombinante comme un traitement potentiel. Elle fonctionne en désactivant la protéine spike avant que le SARS-CoV-2 ne puisse se lier à l'ACE2 à la surface des cellules. Toutefois, de nombreux autres candidats médicaments sont également examinés.
Nafomastat et le MI-1851 inhibent les protéases impliquées dans la division de la protéine spike, à savoir la TMPRSS2 et la furine respectivement, ce qui indique un potentiel de réduction de l'infection au SARS-CoV-2 dans le tube à essai. Il a été démontré que les peptides, qui sont des protéines très courtes similaires aux petites régions de la protéine spike, inhibent la fusion des membranes cellulaires virale et humaine en « bloquant » la protéine spike amorcée sur le virus tandis qu'il change de forme pendant le processus de fusion membranaire. Cela empêche l'entrée virale. Enfin, les inhibiteurs de la PIKfyve sont des bloqueurs connus de l'infection au SARS-CoV-2. La PIKfyve est une kinase lipidique humaine, c'est-à-dire une enzyme qui ajoute un groupe de phosphates à des lipides spécifiques. Dans la mesure où la PIKfyve est impliquée dans le métabolisme endosomal de la voie endocytique d'entrée virale, les inhibiteurs de PIKfyve possèdent une activité antivirale.
Ce ne sont là que quelques exemples des nombreux candidats médicaments en cours d'étude en tant qu'inhibiteurs de l'entrée virale du SARS-CoV-2. De nombreuses cibles sont cependant disponibles pour ceux qui cherchent des traitements pour lutter contre la COVID-19. La protéine spike, l'ACE2, les protéases qui divisent la protéine spike et les composants de la voie endocytique sont des possibilités à l'étude, et de nombreuses substances présentent une activité antivirale à l'égard de chacune de ces cibles. Pour aider les scientifiques à identifier plus rapidement certains de ces candidats potentiels, CAS a publié un jeu de données en source ouverte assemblé à partir de CAS REGISTRY® qui inclut des médicaments antiviraux connus et des composés chimiques connexes structurellement similaires aux antiviraux connus. En savoir plus et télécharger ce document et d'autres ressources CAS en accès libre au sujet de la COVID-19 ici.